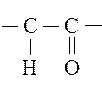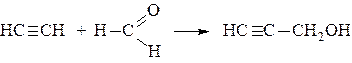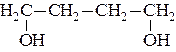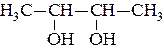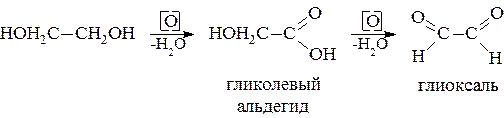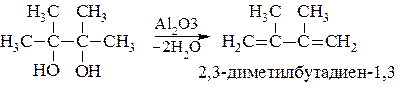|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Ненасыщенные одноатомные спирты
Ненасыщенные спирты могут быть этиленового, ацетиленового и других рядов ненасыщенных соединений. Следует иметь в виду, что алкены не могут нести гидроксил при углероде во втором валентном состоянии (sp2). Структуры
Вот некоторые ненасыщенные спирты:
Виниловый спирт,СН2=СН–ОН, в свободном состоянии не существует. Однако, известны его эфиры, например, винилацетат, получаемый из уксусной кислоты и ацетилена:
Винилацетат используется для получения поливинилацетата и поливинилового спирта, из которого готовят ценные полимеры. Аллиловый спирт обладает свойствами как спиртов, так и олефинов. Получают его гидролизом хлористого аллила в 5 %-ном растворе щёлочи. Используют в производстве глицерина. Пропаргиловый спирт получают конденсацией ацетилена с формальдегидом:
Является промежуточным продуктом в синтезах аллилового спирта, глицерина, дивинила.
35. Спирты, содержащие несколько гидроксильных групп, называются многоатомными. Различают двух-, трех-, четырехатомные и т. д. спирты. Двухатомные спирты называют гликолями, трехатомные – глицеринами. Гидроксильные группы в гликолях содержатся у различных атомов углерода. Гликоли с двумя гидроксилами у одного углеродного атома нестойки. Они отщепляют воду с образованием альдегидов или кетонов. Изомерия гликолей определяется взаимным расположением гидроксильных групп и изомерией углеродного скелета. В зависимости от взаимного расположения групп OH– различают α-, β-, γ-, δ-, … гликоли. В зависимости от характера углеродных атомов, несущих гидроксилы, гликоли могут быть первично-вторичными, первично-третичными, двупервичными, двувторичными и т.д. Названия гликолей могут даваться двумя способами. По номенклатуре ИЮПАК к названию основной углеродной цепи добавляют суффикс –диолиуказывают номера углеродных атомов самой длинной углеродной цепи, несущих гидроксильные группы. Названия α-гликолей могут производиться от названия соответствующего этиленового углерода с добавлением слова гликоль. Классификация и названия гликолей даны ниже на примере бутандиолов:
Способы получения Гликоли могут быть получены всеми обычными синтетическими методами получения спиртов. Примером могут служить следующие реакции. – Гидролиз дигалогенпроизводных насыщенных углеводо-родов и галогенгидринов:
– Гидратация α-окисей в кислой среде:
– Окисление олефинов перманганатом калия в разбавленном водном слабощелочном растворе (реакция Вагнера) или пероксидом водорода в присутствии катализаторов (CrO3):
Физические свойства Низшие гликоли хорошо растворимы в воде. Плотность их выше, чем у одноатомных спиртов. Соответственно выше и температуры кипения из-за значительной ассоциации молекул: например, этиленгликоль кипит при температуре 197,2 °C; пропиленгликоль – при температуре 189 °C и бутандиол-1,4 – при температуре 230 °C. Химические свойства Следует помнить, что в реакцию может вступать как один гидроксил, так и сразу оба. – Окисление двупервичных гликолей дает альдегиды:
– При окислении α-гликолей йодной кислотой происходит разрыв связи между углеродными атомами, несущими гидроксилы, и образование соответствующих альдегидов или кетонов:
Метод имеет большое значение для установления строения α-гликолей. –Результаты внутримолекулярного отщепления водыотгликолей в значительной мере зависят от типа гликоля. Дегидратация α-гликолей протекает с образованием альдегидов или кетонов, γ-гликоли за счет атомов гидроксильных групп отщепляют воду с образованием гетероциклических соединений – тетрагидрофурана или его гомологов:
Первая реакция идёт через образование карбониевого иона с последующим перемещением атома водорода с его электронной парой:
При парофазной дегидратации над Al2O3 α-двутретичных гликолей, называемых пинаконами, получаются диеновые углеводороды:
– Межмолекулярная дегидратация приводит к образованию гидроксиэфиров или циклических простых эфиров:
Этиленгликоль– это вязкая бесцветная жидкость, сладковатая на вкус, tкип = 197,2 °C. В промышленных масштабах получается из этилена по трем схемам.
В смеси с водой этиленгликоль сильно понижает температуру её замерзания. Например, 60 %-ный водный раствор гликоля замерзает при температуре – 49 °C и с успехом применяется как антифриз. Большая гигроскопичность этиленгликоля используется для приготовления печатных красок. Большое количество этиленгликоля идёт на получение пленкообразующих материалов, лаков, красок, синтетических волокон. 36.Из ряда трёхатомных спиртов, алкантриолов, практически важное применение находит лишь глицерин (пропантриол-1,2,3). Получают глицерин почти исключительно омылением жиров или синтезом из пропилена.
При обработке жиров щёлочью получаются натриевые соли жирных кислот – мыла. Отсюда и название процесса щелочного гидролиза сложных эфиров – омыление. Разработка процесса промышленного синтеза глицерина из пропилена позволила значительно сократить расход пищевых жиров на технические цели. Процесс протекает по следующей схеме:
Глицерин – вязкая, бесцветная, сладкая на вкус жидкость. Очень гигроскопичен. tплав = 17,9 °C, tкип = 190 °C с разложением. Растворим в воде в любых соотношениях.
Поиск по сайту: |
 неустойчивы и изомеризуются в
неустойчивы и изомеризуются в