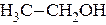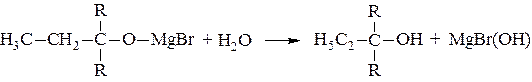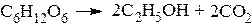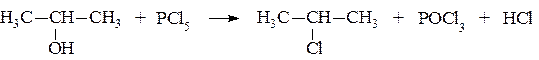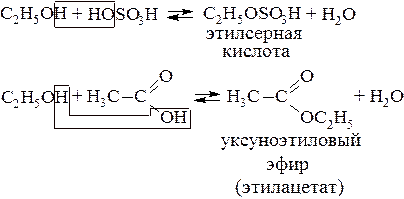|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Отдельные представители
Бензол – жидкость, tплав.= 5,4 °С, tкип= 80,1 °С, с водой образует азеотропную смесь, поэтому при перегонке легко обезвоживается. В промышленности имеет чрезвычайно широкое применение: как растворитель, для получения производных бензола и других соединений (хлорпроизводных, анилина, фенола, красителей, взрывчатых вещ-в, лечебных препаратов, капрона, ацетона, полистирола). Толуол – жидкость, tплав.= –93 °С, tкип= 110,6 °С. Главное применение – производство взрывчатых веществ (тротил: тринитро-толуол), бензойного альдегида, хлористого бензила, которые служат сырьем для анилинокрасочной, парфюмерной, пищевой и других отраслей промышленности. Используется как растворитель. Ксилолы. Смесь ксилолов используется как растворитель. Большое количество пара-ксилола идет на производство синтетического волокона лавсан. Получают ксилолы, главным образом, риформингом узких нефтяных фракций с пределами выкипания близкими к температуре кипения ксилолов. Этилбензолполучают алкилированием бензола этиленом в присутствии AlCl3. Используется в основном для получения стирола. Стирол является простейшим представителем ароматических улеводородов с двойными связями в боковой цепи. Это – жидкость с tкип =146°С. Под действием катализаторов стирол полимеризуется в твёрдую полупрозрачную массу – полистирол. Полистирол имеет высокое электросопротивление и влагостойкость. Полимеризацией стирола и дивинила получают синтетический каучук, пригодный для изготовления шинной резины.
34. Спирты являются гидроксилпроизводными углеводородов. Они могут быть насыщенными и ненасыщенными. Насыщенные одноатомные спирты Изомерия спиртов зависит от строения углеродного скелета и от положения гидроксила. В зависимости от того, какой углерод, первичный, вторичный или третичный, несет гидроксил, различают первичные, вторичные и третичные спирты. Номенклатура Называют спирты обычно по радикалу, связанному с гидроксилом (радикально-функциональная номенклатура). По номенклатуре ИЮПАК название спирта образуется добавлением окончания –ол к названию алкана и указания номера углеродного атома основной цепи, несущего гидроксил; гидроксил должен примыкать к основной цепи. Кроме того, спирты можно называть как замещённые метилового спирта – карбинола:
Способы получения – Гидролиз галогеналкилов
– Синтез с металлорганическими соединениями.
Полученное соединение легко гидролизуется с образованием спирта.
– Гидратация олефинов Реакция идёт в присутствии серной кислоты в жидкой фазе и фосфорной кислоты на носителе в газовой фазе. В промышленности этим способом получают этиловый, изопропиловый спирты.
– Восстановление альдегидов, кетонов и сложных эфиров кислот в присутствии Pt, Pd, Ni, Co и других катализаторов. При этом из альдегидов и сложных эфировполучаются первичные, а из кетонов – вторичные спирты.
– Брожение сахаров под действием дрожжей
Физические свойства Спирты С1–С10 – жидкости, С11 и выше – твердые вещества. Спирты С1–С3 смешиваются с водой в любых соотношениях. По мере увеличения молекулярной массы растворимость спиртов падает. Температуры кипения (°C):CH3OH – 64,7, C2H5OH – 78,5. Первичные спирты среди изомеров кипят выше вторичных и выше третичных. В то же время, температуры кипения спиртов значительно выше температур кипения соответствующих углеводородов и галогеналканов Водородная связь менее прочна по сравнению с обычными химические связями. Чем менее гидроксил спиртов окружён алкильными группами, тем беспрепятственнее протекает ассоциация и тем выше кипит вещество. Отсюда – различие в температурах кипения первичных, вторичных и третичных спиртов. Химические свойства – При действии на спирты щелочных металлов происходит взаимодействие, подобное реакции натрия с водой, хотя и менее бурное. В этой реакции спирт проявляет кислотные свойства:
В результате реакции получаются алкоголяты. Алкоголяты спиртов разлагаются водой:
Это свидетельствует о том, что вода проявляет более выраженные кислотные свойства, чем спирты. – Гидроксильная группа спиртов способна замещаться на галоген при действии различных галогенирующих средств: – галогеноводородных кислот: СН3–СН2ОН + НСl → СН3–СН2Сl + Н2О – галогенидов фосфора:
– тионилгалогенидов; СН3–СН2–CH2–ОН+ SOCl2 → СН3–СН2– CH2Сl + SO2 + HCl – Реакция этерификации При действии на спирты минеральных и органических кислот образуются сложные эфиры. Реакция обратима.
– В присутствии водоотнимающих средств происходит внутри-молекулярное и межмолекулярное отщепление воды от спиртов. Водоотнимающими веществами являются кислоты (H2SO4, H3PO4, щавелевая, бензолсульфокислота и другие), оксиды металлов (Al2O3, SiO2 и другие), соли (CuSO4, ZnCl2, SnCl4 и другие).
При межмолекулярной дегидратации образуются простые эфиры:
При более высокой температуре на этих же катализаторах идёт внутримолекулярная дегидратация с образованием алкенов:
– Дегидрирование и окисление Спирты при температуре 100 °C…180 °C над Cu, Ni, Co, Pt, Pd подвергаются дегидрированию. Окисление может протекать в присутствии кислорода воздуха на медном катализаторе при температуре 300 °C…500 °C, а также под действием хромовой смеси, перманганата калия и других окислителей. В обоих случаях при дегидрировании и окислении из первичных спиртов получаются альдегиды, из вторичных – кетоны. Третичные спирты окисляются очень трудно с разрывом углеродного скелета.
Образование различных продуктов при дегидрировании и окислении позволяет отличить первичные, вторичные и третичные спирты.
Поиск по сайту: |