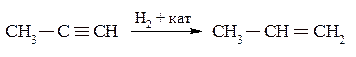|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Изомерия. Номенклатура
Структурная изомерия алкенов начинается с четвертого члена ряда. Однако число изомеров значительно больше. Изомерия алкенов обусловлена, во-первых, строением углеродной цепи, во-вторых – положением двойной связи в цепи и в-третьих – пространственным расположением атомов или групп при углеродах с двойной связью. Последний вид изомерии носит название геометрической или цис-транс-изомерии. Вращение вокруг простой s-связи требует небольшого количества энергии, которая сообщается молекуле при комнатной температуре и даже ниже, при вращении вокруг двойной связи должна разрываться π-связь, а это примерно 250 кДж·моль-1. Поэтому поворот вокруг двойной связи возможен лишь при высоких температурах, облучении или присутствии катализаторов, когда π-связь разрывается. По этим причинам в алкенах не существует изомеров вращения вокруг двойной связи. Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением этих заместителей относительно плоскости π-связи. Так, в молекуле бутена-2 группы СН3 могут находиться либо по одну сторону от двойной связи в цис-изомере, либо по разные стороны в транс-изомере:
При гидрировании оба бутена-2 дают один и тот же бутан. Называют алкены по различным номенклатурам. В тривиальной номенклатуре к названию соответствующего радикала предельного углеводорода добавляют суффикс –ен: этилен, пропилен, бутилен, изобутилен, амилен и т.д. По рациональной номенклатуре олефины называются как производные этилена. При составлении названия по номенклатуре ИЮПАК в качестве основной цепи соединения выбирается самая длинная углеродная цепочка, включающая двойную связь. За основу названия берется название алкана с заменой окончания -ан на Например: СН2=СН2 этилен; этен
27. Способы получения – Основным промышленным источником олефинового сырья являются процессы крекинга и пиролиза нефтяных фракций.
– Дегидратация спиртов. Это обычный лабораторный способ получения этиленовых углеводородов. При температуре
– Из галогенпроизводных отщеплением галогенов или галогеноводородов. Моногалогенпроизводные дают алкены при действии щелочей в спиртовом растворе или органических оснований (диметиланилин, хинолин).
Действие цинковой пыли на дигалогенопроизводные, у которых атомы галогенов расположены у соседних углеродов.
– Гидрирование соединений с тройной связью (ацетиленов) над не очень активным катализатором (Fe, частично «отравленные» Pd и Pt). Физические свойства Этиленовые углеводороды С2 – С4 при нормальных условиях – газы; С5 – С17 – жидкости, С18 и выше – твердые вещества. Изомеры с нормальной углеродной цепочкой кипят выше, чем изомеры с разветвленной цепью. Сдвиг двойной связи к середине молекулы вызывает повышение температуры кипения. Цис-изомеры обычно кипят при более высокой температуре, чем транс-изомеры. Температура плавления транс-изомеров выше, чем для цис-изомеров. Плотность олефинов меньше единицы, но выше, чем соответствующих алканов. В гомологическом ряду она увеличивается. В воде олефины растворимы слабо. Химические свойства Главным структурным элементом, определяющим реакционную способность алкенов, является двойная связь, которая представляет собой сочетание s- и π-связей. π-связь сравнительно легко разрывается и образовывает по месту двойной связи две свободные валентности. По этой причине наиболее характерной для олефинов является реакция присоединения. Однако алкены способны и к реакциям замещения, хотя и в меньшей степени. – Каталитическое гидрирование В присутствии катализаторов Pt, Pd, Ni олефины присоединяют водород с образованием алканов: – Присоединение галогенов протекает очень легко и является качественной реакцией на этиленовую двойную связь.
– Присоединение галогеноводородов
Присоединение галогеноводородов и других полярных молекул протекает в соответствии с правилом В.В.Марковникова: водород присоединяется преимущественно к наиболее гидрогенизированному атому углерода, участвующему в двойной связи.
– Хлорноватистая кислота, диссоциирующая по связи О–Cl присоединяется в соответствии с зарядами получающихся при этом частиц и зарядами на атомах углерода в алкене. Сама хлорноватистая кислота образуется при растворении хлора в воде:
– Олефины в присутствии кислых катализаторов присоединяют воду. – Окисление а) Окисление олефинов перманганатом калия. Реакция Вагнера является качественной реакцией на двойную >С=С< связь (протекание ее сопровождается появлением красно-коричневого осадка диоксида марганца).
б) При более энергичном окислении перманганатом калия, хромовой кислотой, азотной кислотой происходит разрыв по двойной связи с образованием кетонов и кислот: в) Кислород воздуха в присутствии солей серебра превращает олефины в эпоксиды. г) Для установления строения олефинов важна реакция озонирования с образованием озонидов.
28. Диеновые углеводороды содержат в молекуле две двойные связи. Их общая формула СnН2n-2. Свойства этих соединений в значительной мере зависят от взаимного расположения двойных связей. По этому признаку алкадиены можно отнести к трем различным группам: – Углеводороды с кумулированными двойными связями. В этих соединениях обе двойные связи примыкают к одному углероду. По названию первого представителя этого ряда такая система связей называется еще алленовой –Углеводороды с сопряженными (или конъюгированными) двойными связями. Простейшим соединением является дивинил
– Углеводороды с изолированными двойными связями. Например:
Поиск по сайту: |