 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Приклади розв’язання типових задач. Приклад 1. Визначте рН розчину СН3СООН, якщо концентрація кислоти дорівнює 0,15 моль/л ⇐ ПредыдущаяСтр 2 из 2
Приклад 1. Визначте рН розчину СН3СООН, якщо концентрація кислоти дорівнює 0,15 моль/л, α = 1,2 %. Розв’язання.Концентрація іонів Н+ у розчинах слабких одноосновних кислот дорівнює її молярній концентрації, помноженій на ступінь дисоціації кислоти в цьому розчині: [Н+] = Смα, отже, [Н+] = 0,15 · 0,012 = 0,0018 моль/л;
рН = – lg [Н+] = – lg 1,8 · 10-3 = 3 – lg 1,8 = 3 – 0,255 = 2,745 =2,75.
Приклад 2. Складіть рівняння гідролізу солей К3РО4, Cd(NO3)2, KCl. Як змінюється рН під час розчинення у воді цих речовин? Розв’язання.1. Гідроліз К3РО4 відбувається ступінчасто (за трьома ступенями), причому в основному за першим ступенем. Перший ступінь: а) рівняння гідролізу в скороченому іонному вигляді:
б) рівняння гідролізу в повному іонному вигляді:
3К+ +
в) рівняння гідролізу у молекулярному вигляді:
К3PO4 + HOH Û К2 HPO4 + КOH. Другий ступінь: а) HPO б) 2К+ + HPO в) К2HPO4 + HOH Û КH2PO4 + КOH. Третій ступінь:
а) H2PO б) К+ + H2PO в) КH2PO4 + HOH Û H3PO4 + КOH.
Унаслідок гідролізу К3PO4 за першим і другим ступенями утворюються кислі солі, а розчин має рН >7.
2. Гідроліз Сd(NO3)2 відбувається ступінчасто в основному за першим ступенем з утворенням основної солі. Перший ступінь:
а) Cd б) Cd в) Cd(NO3)2 + HOH Û Cd(OH)NO3 + HNO3;
Другий ступінь:
а) Cd(OH)+ + HOH Û Cd(OH)2 б) Cd(OH)+ + NO в) Cd(OH)NO3 + HOH Û Cd(OH)2
Унаслідок гідролізу концентрація іонів Гідрогену Н+ перевищує концентрацію гідроксид-іонів ОН
3. Сіль KCl, утворена сильною кислотою і сильною основою, гідролізу не піддається, отже, рН = 7.
Приклад 3. У нагрітий розчин ZnCl2 помістили попередньо зачищений шматок цинку. Який газ виділяється при цьому? Напишіть рівняння реакцій. Розв’язання. Нагрівання зумовлює зміщення рівноваги у розчині в бік продуктів гідролізу: ZnCl2 + HOH Û Zn(OH)Cl + HCl; Zn2+ + HOH Û Zn(OH)+ + H+.
Утворювані іони Гідрогену взаємодіють із металевим цинком з виділенням водню:
Zn + 2HCl = ZnCl2 + H2 Zn + 2H+ = Zn2+ + H2 Приклад 4. Маса ОН Розв’язання. Молярна маса ОН
Округляючи значення логарифму до 0,01, отримаємо:
pOH = – lg [OH = – (0,49 – 3) = 2,51.
Оскільки рН + рОН = 14, то рН = 14 – рОН = 14 – 2,51 = 11,49.
Приклад 5. Визначити рН розчину Ва(ОН)2, молярна концентрація якого дорівнює 0,0256 моль/л, ступінь дисоціації електроліту в ньому складає 79 %. Розв’язання. Концентрацію OH
[OH
де k = 2, оскільки 1 моль Вa(ОН)2 при дисоціації утворює 2 молі іонів OH
[OH pOH = – lg 0,0404 = – lg 4,04∙10-2 = 2 – 0, 606 = 1,39. рН = 14 – pOH = 14 – 1,39 = 12,61.
Питання для самоперевірки 1. Дайте визначення іонного добутку води. Як він змінюється з підвищенням температури? 2. Що таке водневий і гідроксильний показники? 3. Сформулюйте сучасну теорію індикаторів. 4. Що таке показник титрування та інтервал переходу забарвлення індикатору? 5. Для чого потрібні буферні суміші? З чого вони складаються і як діють? 6. Дайте визначення гідролізу. Які солі підлягають гідролізу?
Контрольні завдання 10.1. Обчисліть [Н+] та [ОН-] в розчині, рОН якого дорівнює 6,2. 10.2. Яких іонів Н+ чи ОН- і у скільки разів більше в розчині з рН = 5? 10.3. Визначте [H+] та [OH-] в розчині натрій гідроксиду, якщо рОН = 2,25. 10.4. рН = 9,98. Визначте масу кальцій гідроксиду у 3 л розчину, якщо α =43 %. 10.5. Напишіть рівняння ступінчастого гідролізу у молекулярній та іонно-молекулярній формах для солей: CuSO4, FeCI3, Na3PO4. 10.6. Складіть іонні та молекулярні рівняння гідролізу таких солей: Pb(NO3)2, Na2CO3, CoCI2. Яке значення рН (більше або менше 7) мають розчини цих солей?
Вивчення цього матеріалу допоможе студентам мати чітке уявлення про електролітичну дисоціацію води, дію буферних розчинів та індикаторів у кислих та лужних середовищах, засвоїти механізм гідролізу солей та розраховувати водневий і гідроксильний показники.
Поиск по сайту: |

 ;
;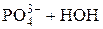 Û 2К+ + HPO
Û 2К+ + HPO 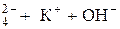 ;
; ;
; Û К+ + H2PO
Û К+ + H2PO  ;
; + HOH Û H3PO4 + OHˉ;
+ HOH Û H3PO4 + OHˉ;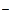 ;
; + HOH Û Cd(OH)
+ HOH Û Cd(OH) 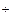 + H
+ H  + HOH Û Cd(OH)+ + NO
+ HOH Û Cd(OH)+ + NO  + Н+;
+ Н+; ;
; =
= 
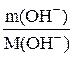 =
=  = 0,0031 моль/л.
= 0,0031 моль/л. = – (lg 3,1 + lg 10–3) =
= – (lg 3,1 + lg 10–3) =