|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Компоненты цепи окислительного фосфорилирования
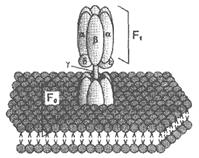
 Комплекс I – НАДН2 дегидрогеназный комплекс –самый большой из дыхательных ферментных комплексов – имеет молекулярную массу свыше 800КДа, состоит из более 22 полипептидных цепей, в качестве коферментов содержит ФМН и 5 железо-серных (Fe2S2 и Fe4S4) белков. Комплекс II – СДГ. В качестве коферментов содержит ФАД и железо-серный белок.Комплекс III – Комплекс b-c1 (фермент QH2 ДГ), имеет молекулярную массу 500КДа, состоит из 8 полипептидных цепей, и вероятно существует в виде димера. Каждый мономер содержит 3 гема, связанных с цитохромами b562, b566, с1, и железо-серный белок.Комплекс IV – Цитохромоксидазный комплекс имеет молекулярную массу 300КДа, состоит из 8 полипептидных цепей, существует в виде димера. Каждый мономер содержит 2 цитохрома (а и а3) и 2 атома меди.Коэнзим Q (убихинон). Липид, радикал которого у млекопитающих образован 10 изопреноидными единицами (Q10). Убихинон переносит по 2Н+ и 2е-. Комплекс I – НАДН2 дегидрогеназный комплекс –самый большой из дыхательных ферментных комплексов – имеет молекулярную массу свыше 800КДа, состоит из более 22 полипептидных цепей, в качестве коферментов содержит ФМН и 5 железо-серных (Fe2S2 и Fe4S4) белков. Комплекс II – СДГ. В качестве коферментов содержит ФАД и железо-серный белок.Комплекс III – Комплекс b-c1 (фермент QH2 ДГ), имеет молекулярную массу 500КДа, состоит из 8 полипептидных цепей, и вероятно существует в виде димера. Каждый мономер содержит 3 гема, связанных с цитохромами b562, b566, с1, и железо-серный белок.Комплекс IV – Цитохромоксидазный комплекс имеет молекулярную массу 300КДа, состоит из 8 полипептидных цепей, существует в виде димера. Каждый мономер содержит 2 цитохрома (а и а3) и 2 атома меди.Коэнзим Q (убихинон). Липид, радикал которого у млекопитающих образован 10 изопреноидными единицами (Q10). Убихинон переносит по 2Н+ и 2е-.  убихинон ↔ семихинон ↔ гидрохинонЦитохром с. Периферический водорастворимый мембранный белок с массой 12,5КДа, содержит 1 полипептидную цепь из 100 АК, и молекулу гема.Молекулярные соотношения между компонентами дыхательной цепи отличаются в разных тканях. Например, в миокарде, на 1 молекулу НАДН2 дегидрогеназного комплекса приходиться 3 молекулы комплекса b-c1, 7 молекул цитохромоксидазного комплекса, 9 молекул цитохрома С и 50 молекул убихинона.2). Фосфорилирование осуществляется АТФ-синтетазой (Н+-АТФ-аза) — интегральным белком внутренней мембраны митохондрий. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1. Гидрофобный комплекс F0 погружён в мембрану. убихинон ↔ семихинон ↔ гидрохинонЦитохром с. Периферический водорастворимый мембранный белок с массой 12,5КДа, содержит 1 полипептидную цепь из 100 АК, и молекулу гема.Молекулярные соотношения между компонентами дыхательной цепи отличаются в разных тканях. Например, в миокарде, на 1 молекулу НАДН2 дегидрогеназного комплекса приходиться 3 молекулы комплекса b-c1, 7 молекул цитохромоксидазного комплекса, 9 молекул цитохрома С и 50 молекул убихинона.2). Фосфорилирование осуществляется АТФ-синтетазой (Н+-АТФ-аза) — интегральным белком внутренней мембраны митохондрий. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1. Гидрофобный комплекс F0 погружён в мембрану.
1. Внутренняя мембрана митохондрий непроницаема для всех ионов. 2. Она содержит ряд белков-переносчиков, осуществляющих транспорт необходимых метаболитов и неорганических ионов. 3. При прохождении электронов по дыхательной цепи внутренней мембраны происходит перемещение Н+ из матрикса в межмембранное пространство. 4. При достаточно большом протонном градиенте протоны начинают «течь» через АТФ-синтетазу, что сопровождается синтезом АТФ. Современные представленияВ настоящее время открыты все основные компоненты ЦПЭ ОФ, изучено их строение, свойства. Открыты основные принципы окислительного фосфорилирования, механизмы некоторых стадий, регуляция окислительного фосфорилирования.Механизм окисленияКомплексы цепи окисления располагаются в мембране в порядке повышения их редокс-потенциала. При переходе электрона от комплекса с низким редокс-потенциалом к комплексу с более высоким редокс-потенциалом происходит выделение свободной энергии. Изменение свободной анергии при переносе электронов по ЦПЭ.E-FMN — комплекс I; E-FAD — комплекс II, b-c1 — комплекс III; aa3 — комплекс IV. Часть этой свободной энергии используется для переноса протонов из матрикса митохондрий в межмембранное пространство, при этом на внутренней мембране создается протонный градиент (∆рН) (в матриксе рН выше, чем в цитозоле). Так как каждый протон несет положительный заряд, на мембране появляется разность потенциалов (∆V), внутренняя сторона мембраны заряжается отрицательно, внешняя – положительно. В совокупности протонный градиент и разность потенциалов составляют электрохимический потенциал, который в типичной клетке составляет около 220 мВ, и складывается из 160 мВ ∆V и 60 мВ ∆рН (при ∆рН=1). Механизм переноса протонов через мембрану до конца не изучен. Вероятно, у разных компонентов дыхательной цепи существуют разные механизмы сопряжения транспорта е- с перемещением Н+. Однако установлено что важную роль в этом процессе играет КоQ. Цепь окисления 1. 2е- от НАДН2, проходят через I комплекс (ФМН→SFe белок) на КоQ, высвобождаемая при этом энергия обеспечивает перекачку Н+ (механизм переноса Н+ неизвестен).2. КоQ с 2е- забирает 2Н+ из матрикса и превращается в КоQН2 (восстановление КоQ проходит также с участием комплекса II).3. КоQН2 переносит 2е- на комплекс III, а 2Н+ в межмембранное пространство.4. Цитохром С переносит е- c III комплекса на IV комплекс.5. IV комплекс сбрасывает е- на О2, высвобождаемая при этом энергия обеспечивает перекачку Н+ (механизм переноса Н+ неизвестен). Изменение свободной анергии при переносе электронов по ЦПЭ.E-FMN — комплекс I; E-FAD — комплекс II, b-c1 — комплекс III; aa3 — комплекс IV. Часть этой свободной энергии используется для переноса протонов из матрикса митохондрий в межмембранное пространство, при этом на внутренней мембране создается протонный градиент (∆рН) (в матриксе рН выше, чем в цитозоле). Так как каждый протон несет положительный заряд, на мембране появляется разность потенциалов (∆V), внутренняя сторона мембраны заряжается отрицательно, внешняя – положительно. В совокупности протонный градиент и разность потенциалов составляют электрохимический потенциал, который в типичной клетке составляет около 220 мВ, и складывается из 160 мВ ∆V и 60 мВ ∆рН (при ∆рН=1). Механизм переноса протонов через мембрану до конца не изучен. Вероятно, у разных компонентов дыхательной цепи существуют разные механизмы сопряжения транспорта е- с перемещением Н+. Однако установлено что важную роль в этом процессе играет КоQ. Цепь окисления 1. 2е- от НАДН2, проходят через I комплекс (ФМН→SFe белок) на КоQ, высвобождаемая при этом энергия обеспечивает перекачку Н+ (механизм переноса Н+ неизвестен).2. КоQ с 2е- забирает 2Н+ из матрикса и превращается в КоQН2 (восстановление КоQ проходит также с участием комплекса II).3. КоQН2 переносит 2е- на комплекс III, а 2Н+ в межмембранное пространство.4. Цитохром С переносит е- c III комплекса на IV комплекс.5. IV комплекс сбрасывает е- на О2, высвобождаемая при этом энергия обеспечивает перекачку Н+ (механизм переноса Н+ неизвестен).
 Созданный в цепи окисления электрохимический потенциал используется на: 40-45% для фосфорилирования; на 25% для транспорта веществ через мембрану и на 30-35% для теплопродукции. I, III и IV комплексы ЦПЭ называют пунктами сопряжения дыхания и фосфорилирования, так как они создают электрохимический потенциал, необходимый для фосфорилирования.1). Механизм фосфорилированияАТФ-синтетаза обеспечивает обратимое взаимопревращение энергии электрохимического потенциала и энергии химических связей. Электрохимический потенциал заставляет Н+ двигаться по каналу АТФ-синтазы в матрикс. При каждом переносе протонов через канал Fo энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация а- и β-субъединиц и все 3 активных центра, образованных парам α- и β-субъединиц, катализируют очередную фазу цикла 1) связывание АДФ и Н3РО4; 2) образование фосфоангидридной связи АТФ; 3) освобождение конечного продукта АТФ. Таким образом, электрохимический потенциал, генерируемый в каждом из 3 пунктов сопряжения дыхания и фосфорилирования, используется для синтеза одной молекулы АТФ. Созданный в цепи окисления электрохимический потенциал используется на: 40-45% для фосфорилирования; на 25% для транспорта веществ через мембрану и на 30-35% для теплопродукции. I, III и IV комплексы ЦПЭ называют пунктами сопряжения дыхания и фосфорилирования, так как они создают электрохимический потенциал, необходимый для фосфорилирования.1). Механизм фосфорилированияАТФ-синтетаза обеспечивает обратимое взаимопревращение энергии электрохимического потенциала и энергии химических связей. Электрохимический потенциал заставляет Н+ двигаться по каналу АТФ-синтазы в матрикс. При каждом переносе протонов через канал Fo энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация а- и β-субъединиц и все 3 активных центра, образованных парам α- и β-субъединиц, катализируют очередную фазу цикла 1) связывание АДФ и Н3РО4; 2) образование фосфоангидридной связи АТФ; 3) освобождение конечного продукта АТФ. Таким образом, электрохимический потенциал, генерируемый в каждом из 3 пунктов сопряжения дыхания и фосфорилирования, используется для синтеза одной молекулы АТФ. Коэффициентом окислительного фосфорилирования (Р/О) называют отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания. Окисление молекулы НАДН2 в ЦПЭ сопровождается образованием 3 молекул АТФ, следовательно, для НАДН2 Р/О = 3. Электроны от ФАД-зависимых дегидрогеназ поступают в ЦПЭ на KoQ, минуя первый пункт сопряжения. Поэтому образуются только 2 молекулы АТФ, следовательно, для сукцината Р/О = 2. Эти величины отражают теоретический максимум синтеза АТФ, фактически эта величина меньше из-за затрат на транспорт. Дыхательный контроль В норме субстраты окислительного фосфорилирования и О2 находятся в достаточном количестве, поэтому лимитирует ЦПЭ только количество АДФ, так как оно зависит от интенсивности потребления АТФ. При нагрузке концентрация АДФ увеличивается и ускоряет дыхание и фосфорилирование. В состоянии покоя количество АДФ снижается и тормозит дыхание и фосфорилирование. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. В результате дыхательного контроля скорость синтеза АТФ соответствует потребностям клетки в энергии. Общее содержание АТФ в организме 30—50 г, но каждая молекула АТФ в клетке «живёт» меньше минуты. В сутки у человека синтезируется 40—60 кг АТФ и столько же распадается.
Поиск по сайту: |