 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Відповідно, визначивши експериментальну різницю в температурах кипіння розчину і чистого розчинника
Метод визначення молярної маси сполук за зниженням температури замерзання називається кріоскопією, відповідно за підвищенням температури кипіння - ебуліоскопією. Визначення депресії біологічних рідин (крові, лімфи, сечі) дає можливість розрахувати їх "осмотичну" концентрацію, тобто сумарну концентрацію всіх частинок, які неможливо визначити звичайними методами кількісного аналізу. Для розчинів неелектролітів, які перебувають у вигляді молекул осмотична концентрація дорівнює молярній. Сосм. = С мол. Осмотичний тиск можна визначити за експериментальною депресією:
де R = 8,314 Дж/моль *К К=1,86 Для розчинів електролітів, які містять суміш дисоційованих йонів. Сосм=іСм де і=1+α(п-1) і- ізотонічний коефіцієнт; п - число продисоційованих частинок; α- ступінь дисоціації. Більш точно осмотичний тиск можна визначити експериментально за депресією температури плавлення: Отже, осмотичний тиск визначають за формулою:
Приклади розв'язування задач. Задача 1. Розрахувати молекулярну масу вуглеводу, якщо при розчиненні 18 г цієї сполуки в 100 г води одержали розчин з температурою кипіння 100,52 °С. Для розв'язування цієї задачі скористаємось законом Рауля, згідно якого
де m вуглеводу =18 г Е = 0,516 °С/моль*кг Δtкип.=tкип.розчину-tкип.розчинника =100,52-100=0,52 °С m(H2O) = 100 г=0,100 кг
Задача 2. Яка температура замерзання розчину цукру виготовленого розчиненням 50 г цукру у 200 г води? Згідно закону Рауля: де mx = 50 г m H2O= 200 г= 0,2 кг М (С12 Н22011) = (12·12+22+11·16)= 342 г/моль Отже Звідки tзам.розч.=tзам. розчинника- Δtзам = 0- 1.36 = -1,36 °С. ЗАНЯТТЯ №6 Тема: Колігативні властивості розчинів. Осмос і осмотичний тиск. Актуальність теми:Осмос має важливе значення для рослинних і тваринних організмів, створюючи необхідні умови для нормального протікання біофізичних і біохімічних процесів. В людському організмі необхідне постійне значення осмотичного тиску крові і інших біологічних рідин. Значення осмотичних властивостей розчинів, їх залежність від різних речовин, робить можливим регулювання і підтримання необхідних параметрів стану організму. Навчальні цілі: Знати: залежність осмотичного тиску від концентрації розчинених електролітів і неелектролітів. Знати осмотичний тиск різних біологічних рідин і вплив на нього різних факторів. Вміти: визначати і розраховувати осмотичний тиск розчинів і основних біологічних рідин. Самостійна позааудиторна робота студентів. 1. Дифузія в розчинах і її значення для біологічних систем. 2. Закон Фіка. 3. Осмос і осмотичний тиск. 4. Закон Вант-Гоффа для осмотичного тиску. 5. Осмотичні властивості розчинів неелектролітів. 6. Осмотичні властивості розчинів електролітів. Коефіцієнт Вант-Гоффа. 7. Гіпер-, гіпо- і ізотонічні розчини. 8. Процеси плазмолізу і гемолізу. 9. Значення осмосу і осмотичного тиску для біологічних систем. 10. 10.Ізотонічні розчини (фізіологічні) як медичні препарати в медицині Контрольні питання. 1. Дайте визначення законів Фіка, Генрі, Дальтона, Сеченова, Вант-Гоффа. 2. Яка величина осмотичного тиску для фізіологічного розчину? Якої концентрації мають бути розчини хлориду натрію та глюкози, щоб розчини були фізіологічними? 3. Дайте визначення поняттю дифузія, осмотичний тиск, ізотонічний коефіцієнт, осмос, осмотична концентрація. 4. Що таке ізотонічний розчин, гіпер- і гіпотонічні розчини, гемоліз, плазмоліз? 5. Як визначати молярну концентрацію еквівалентів, моляльність і масову частку розчину? Зв’язок між ними. 6. Обчислити осмотичний тиск розчину глюкози з концентрацією 0,287 моль/л. 7. Обчислити концентрацію глюкози (моль/л) в розчині, який ізотонічний по відношенню до плазми крові. 8. Визначити значення ізотонічного коефіцієнту для 0,85 % розчину хлориду натрію, ізотонічного по відношенню до крові. Самостійна робота на занятті. Виконати лабораторні роботи: 1. Визначити осмотичний тиск розчину сахарози. 2. Виростити “штучну клітину”. 3. Одержати деревоподібні утворення.
Поиск по сайту: |
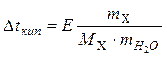 звідки
звідки 




 /моль
/моль

