 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ШЕСТИЧЛЕННІ ГЕТЕРОЦИКЛИ З ДВОМА ГЕТЕРОАТОМАМИ
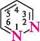
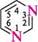
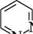
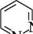
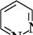
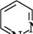
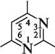
ДІАЗИНИ Діазинами називають шестичленні гетероароматичні сполуки, які містять як гетероатоми два атоми Нітрогену піридинового типу, а також бі- і поліциклічні сполуки, що включають діазиновий цикл. Існує три ізомерних діазини — піридазин (1,2-діазин), піримідин (1,3-діазин) і піразин (1,4-діазин). Глава 32
СІ піридазин піримідин піразин За будовою і властивостями ці сполуки багато чим нагадують піридин. Подібно до піридину, молекули піридазину, піримідину і піразину мають у своєму складі замкнену кон'юговану систему із шести я-електронів і виявляють ароматичний характер. Неподілені пари електронів атомів Нітрогену не беруть участі в кон'югації і надають діазинам основних властивостей. Через взаємний дезактивуючий вплив атомів Нітрогену один на одного піридазин, піримідин і піразин — слабші основи, ніж піридин (рKВН+ піридазину у воді — 2,33; піримідину — 1,3; піразину — 0,6; піридину — 5,25). Тому діазини, незважаючи на наявність двох основних центрів, утворюють солі тільки з одним еквівалентом мінеральної кислоти. N № II + Н28О4 N , нзо:
піримідин піримідиній гідросульфат Наявність у структурі молекул піридазину, піримідину та піразину двох атомів Нітрогену піридинового типу приводить до значного зниження електронної густини на атомах Карбону діазинового циклу. Тому діазини характеризуються дуже низькою реакційною здатністю в реакціях SЕ і, навпаки, високою активністю в реакціях SN. Реакції електрофільного заміщення можливі тільки тоді, коли діазиновий цикл активований електронодонорними групами (—NH2, —OH тощо). ПІРИДАЗИН (1,2-ДІАЗИН)
Піридазин — безбарвна рідина зі слабким запахом (т. кип. 207°С), розчинна у воді, в етанолі, у бензені, діетиловому етері, не розчиняється в петролейному ефірі. Піридазин і його похідні добувають конденсацією гідразину з насиченими або ненасиченими 1,4-дикарбонільними сполуками. Х\/Пч ____ XI
м малеїндіальдегід шридазин
чо о -2Н2О н2с' -сн, , к Перевага синтезів з ненасиченими 1,4-дикарбонільними сполуками полягає в тому, що продукт, який утворюється, не потребує подальшого окиснення. Піридазин — слабка основа. З кислотами (хлоридною, пікриновою) та алкіл-галогенідами піридазин утворює солі лише за участі одного атома Нітрогену. П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи
н СГ
піридазиній хлорид К-метилггіридазиній йодид У реакції електрофільного заміщення піридазин вступає дуже важко. Здійснити реакції нітрування, сульфування, галогенування практично не вдається. Під дією пероксикислот піридазин окиснюється, утворюючи N-оксид:
СНзСОООН -сн3соон О" піридазин-Т^-оксид При відновленні піридазину натрієм у спиртовому розчині або каталітичному гідруванні розкривається цикл, і утворюється тетраметилендіамін.
-^-*- н2к— сн2— сн2— сн2— сн2— кн2 тетраметилендіамін Похідні піридазину використовують як лікарські препарати та гербіциди. Так, піридазиновий цикл міститься в структурах лікарського препарату антибактеріальної дії — сульфапіридазину, і гербіциду — феназону, який використовують для знищення бур'янів на полях цукрових буряків.
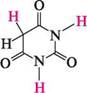
ПІРИМІДИН (1,3-ДІАЗИН) Способи добування.Піримідин і його похідні найчастіше одержують 2І) конденсацією сечовини або тіосечовини з 1,3-дикарбонільними сполуками. N Так, при взаємодії малонового естеру із сечовиною в присутності натрій етоксиду утворюється похідна піримідину — барбітурова кислота, що існує в оксо-та гідроксиформі. О.
—ос2н5 -2С2Н5ОН' малоновий естер Глава 32 596 Г ОН НО —► Н2СС = О ^^г НС С—ОН Чс—>/ с=к о/ н но оксоформа іідроксиформа барбітурова кислота Для добування піримідину барбітурову кислоту дією фосфор трихлороксиду або пентаоксиду перетворюють на 2,4,6-трихлоропіримідин (у реакцію вступає гідроксиформа), який потім відновлюють.
.н РОСІз н барбітурова кислота 2,4,6-трихлоропіримідин піримідин Фізичні властивості.Піримідин — безбарвна кристалічна речовина (т. пл. 22,5 °С), легкорозчинна у воді, в етанолі, у діетиловому етері. хімічні властивості.За хімічними властивостями піримідин подібний до піридину, але, як і інші діазини, характеризується більш низькою реакційною здатністю. Незважаючи на наявність у молекулі піримідину двох основних центрів, у реакціях з мінеральними кислотами він утворює солі за участі лише одного атома Нітрогену:
N сг піримідиній хлорид
(конц.); Н25О4 (конц.)
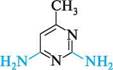
2-аміно-4-гідрокситримідин 2-амшо-4-гідрокси-5-нітропіримідин
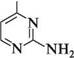
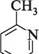
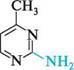
2-амінопіримідин 2-аміно-5-бромопіримідин П'яти-та ШеСтиЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи З" І Нуклеофільні реагенти атакують у молекулах піримідину та його похідних електронодефіцитні положення 2, 4 та 6. Так, при взаємодії 4-метилпіримідину з натрій амідом у середовищі рідкого амоніаку утворюються моно- і діамінопохідні піримідину:
NаNН2;NНз 4-метилпіримідин 2-аміно-4-метилтримідин 2,4-дшміно-б-метилтримідин Нуклеофільне заміщення в ряду піримідинів часто супроводжується розкриттям циклу. найважливіші похідні піримідину.Серед похідних піримідину важливу біологічну роль виконують гідрокси- і амінопіримідини. Вони входять до складу нуклеїнових кислот, вітамінів, антибіотиків, лікарських препаратів і т. ін. Барбітурова кислота (2,4,6-тригідроксипіримідин) — безбарвна кристалічна речовина (т. пл. 245°С), малорозчинна у воді та етанолі, добре розчиняється в діетиловому етері.
ОН он Барбітурову кислоту добувають конденсацією сечовини з малоновим естером (див. с. 495). Тому її можна розглядати як циклічний уреїд малонової кислоти (див. с. 595). Барбітурова кислота — таутомерна сполука, в якій одночасно виявляють два види таутомерії — кето-енольну і лактам-лактимну. Кето-енольна таутомерія зумовлена міграцією протона Н+ метиленової групи, а лактам-лактимна — груп
Поиск по сайту: |

 нсг ^с^
нсг ^с^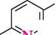 ' 2*4
' 2*4


 N11,
N11,
 о он
о он
 Через електроноакцепторний вплив двох атомів Нітрогену піримідин прак
Через електроноакцепторний вплив двох атомів Нітрогену піримідин прак -Н2О
-Н2О
 но
но