 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
СУЛЬФУрОрГанІЧнІ СПОЛУКи. Реакція лужного плавлення
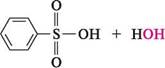
120-150 °С; НС1 о Реакція лужного плавлення. Сульфогрупа може бути видалена з ароматичного кільця при дії різних нуклеофілів. Лужне плавлення солей сульфонових кислот проводять із твердими лугами при температурі 300—350 °С. За допомогою реакції лужного плавлення добувають не тільки феноли (див. с. 348, 360), але й інші класи органічних сполук: Тон Аг—ОН фенол Аг—8Н
Д2__ §0 ^д. ___________ І гіофенол
З -N^80, ТЧГаТЧГН. Аг— амін Аг— нітрил Основною вадою способу є жорсткі умови реакції і виділення значної кількості відходів (екологічний аспект). електрофільне заміщення (SE) по ароматичному ядру.Сульфогрупа —SO3H, будучи сильним електроноакцептором, дезактивує ароматичне ядро в реакціях SE і орієнтує заміщення в м-положення.
Оі ОКРЕМІ ПРЕДСТАВНИКИ. ВИКОРИСТАННЯ 2-аміноетансульфонова кислотаH2N—CH2—CH2—SO3H. Безбарвна кристалічна речовина, розчинна у воді, нерозчинна в спирті. Використовується в медичній практиці під назвою «Тауфон». Застосовують для лікування захворювань сітківки, рогівки очей, катаракти. Бензенсульфонова кислота C6Н5—SO3H. Безбарвна кристалічна речовина, яка розпливається на повітрі (т. пл. 171—172°С (безводн.) і 45—46°С (моногідрату)). Добре розчиняється у воді, етанолі. Натрієву сіль бензенсульфокислоти використовують у синтезі фенолу. п -толуенсульфонова кислотап-CH3C6H4SO3H. Безбарвна кристалічна речовина (т. пл. 104°С (моногідрат)). Добре розчиняється у воді, в етанолі, етері, у багатьох органічних розчинниках. Використовується як кислотний каталізатор. Вищі сульфонати(C14—C18) R—SO3Na. Використовують як ПАР, мийні речовини, емульгатори і флотаційні реагенти. Глава 29
Айра РЕМСЕН (1846-1927) Американський хімік. Відомий як блискучий педагог, новатор системи хімічної освіти в США. Його книга «Основи теоретичної хімії» (1876) витримала 28 видань і 15 перекладів. Працював в галузі органічної хімії. Спільно зі своїм співробітником К. Фальбергом уперше синтезував сахарин (1879) і запатентував спосіб його виробництва. БензенсульфонілхлоридС6Н5—SO2Cl. Рідина, яка димить на повітрі (т. кип. 251,5°С). Нерозчинний у воді, добре розчиняється в етанолі, етері, у хлороформі. Пари мають сильну подразливу дію на слизові оболонки органів зору і дихання. ГДК 0,3 мг/м3. Використовують у синтезі бензенсульф-аміду, алкіл ових естерів бензенсульфокислоти. Вищі сульфаміди(C14—C18) R—SO2NH2 є вихідними продуктами в синтезі відбілюва-чів, емульгаторів і т. д. п-амінобензенсульфамід(сульфаніламід, стрептоцид). Безбарвна кристалічна речовина, важкорозчинна у воді і спирті, легко — у гарячій воді, лугах (т. пл. 164—167°С). Є родоначальною структурою групи хіміотерапевтичних препаратів антибактеріальної дії — сульфаніламідів. тчн
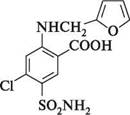
5-(аміносульфоніл)-4-хлор-2-[(фурилметил)аміно]бензойна кислота.Безбарвна кристалічна речовина, нерозчинна у воді. Виявляє дуже сильний діуретичний ефект. У медичній практиці використовується під назвою «Фуросемід».
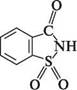
Імід о-сульфобензойної кислоти(сахарин). Безбарвна кристалічна речовина, важкорозчинна у воді (1:250), спирті (1:40) (т. пл. 224—226°С). Дигідрат натрієвої солі сахарину називають кристалозою. Солодший за цукор у 500—600 разів. Виводиться із сечею в незміненому вигляді.
Використовується як підсолоджувач дієтичних харчових продуктів. Глава ЗО
Гетероциклічними сполуками називають групу органічних речовин, цикли яких містять у своєму складі разом з атомами Карбону один або кілька атомів інших елементів — гетероатомів (O, N, S, P, Si тощо). Найбільш вивчені і розповсюджені нітрогено-, оксигено- і сульфуровмісні гетероцикли. Близько 2/3 відомих природних і синтетичних речовин є сполуками гетероциклічної природи. Гетероцикли входять до складу вітамінів, алкалоїдів, антибіотиків, природних пігментів, нуклеїнових кислот, ферментів тощо. Багато гетероциклічних сполук мають високу біологічну активність, тому невипадково більше половини всіх лікарських речовин містять у своїй структурі гетероциклічні фрагменти. У попередніх главах було розглянуто деякі гетероциклічні сполуки (етиленоксид, лактони (cм. с. 469), лактами (с. 488), ангідриди двохосновних карбонових кислот (с. 426) тощо). їхні хімічні властивості практично не відрізняються від властивостей аналогів ациклічної будови (етерів, амінів тощо). КЛАСИФІКАЦІЯ В основу класифікації гетероциклів покладено такі ознаки: > розмір циклу (три і більше атомів): N Н Н азиридин; азетидин; етиленімін триметиленімін природа гетероатома (O, S, N, P, Si, Bi, Te тощо): фуран; тіофен; оксол тіол кількість гетероатомів (один, два, три тощо):
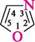
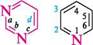
піридин; піримідин; 831111 1,3-діазин 1,3,5-триазин міра насиченості циклу (насичені, ненасичені, ароматичні гетероцикли):
Н н н піролідин 3-піролін пірол Глава 30 В особливу групу виділені конденсовані системи:
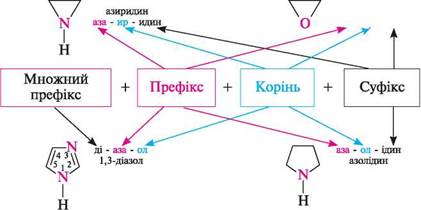
пурин НОМЕНКЛАТУРА Для гетероциклічних сполук застосовують тривіальні та систематичні назви. Тривіальні назви прийняті номенклатурою ШРАС і в більшості випадків кращі. При побудові систематичних назв гетероциклів за номенклатурними правилами ШРАС враховується природа і кількість гетероатомів, а також розмір циклу і міра його насиченості. При цьому природа гетероатома відображається в префіксі, розмір циклу — у корені, а міра насиченості — у суфіксі назви. Для позначення гетероатомів використовують префікси окса- (O), тіа- (S), аза- (N) тощо. Розмір циклу позначається коренями -ир- (три-), -ет- (чотири-), -ол- (п'яти-), -ин-(шести-), -еп- (семичленний), а міра насиченості — суфіксами -идин (-ідин) (насичений цикл з атомом Нітрогену), -ан (насичений цикл без атома Нітрогену), -ин(-ін) (ненасичений цикл). У назві гетероциклів з максимально можливою кількістю подвійних зв'язків у циклі суфікс не вказується. Для частково гідрованих сполук використовують префікси дигідро-, тетрагідро- із указівкою номерів атомів, до яких приєднаний Гідроген. якщо атом Гідрогену приєднаний тільки до одного атома циклу, то в назві вказується номер гідрованого атома і символ н. У шести-і семичленних нітрогеновмісних гетероциклах повна насиченість циклу позначається префіксом пергідро-. Кількість гетероатомів одного виду вказують у назві множними префіксами ди- (ді-), три-, тетра- і т. д. якщо гетероцикл містить кілька різних гетероатомів, то називають їх у певній послідовності: окса-, тіа-, аза- тощо. При складанні назви в цілому допускаються спрощення. Приклади систематичних і тривіальних назв деяких гетероциклів:
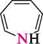
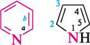
Назва ГетерОЦиКЛІЧнІ СПОЛУКи Тричленні гетероциклічні сполуки1: Х7 оксиран; етиленоксид' NН азиридин; етиленімін * тиран; етиленсульфід ' Чотиричленні гетероциклічні сполуки: І— N11 оксетан азетидин тієтан П'ятичленні гетероциклічні сполуки з одним гетероатомом: о о фуран *; оксол о N11 пірол *; азол О тіофен *; тіол N11 З-шролін *; 2,5-дигідропірол; азолін NН піролідин *; тетрагідропірол; азолідин П'ятичленні гетероциклічні сполуки з двома гетероатомами: з\\ N6 піразол *; 1,2-діазол імідазол *; 1,3-діазол тіазол , 1,3-тіазол і О оксазол *; 1,3-оксазол шестичленні гетероциклічні сполуки з одним гетероатомом:
N піридин *; азин
О 4Н-піран
піперидин *; пергідроазин
О тетрагідропіран шестичленні гетероциклічні сполуки з двома гетероатомами:
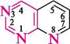
¥ піридазин *; 1,2-діазин піримідин *; 1,3-діазин піразин •; 1,4-діазин морфолін *; тетрагідро-1,4-оксазин; 1,4-оксазин
4 оксазин *; 4Н-1,4-оксазин тіазин *; 4Н-1,4-тіазин піперазин *; пергідро-1,4-діазин
Глава 30 Семичленні гетероциклічні сполуки з одним гетероатомом:
О' Нумерацію атомів у гетероциклі зазвичай починають з гетероатома і проводять у тому напрямі, щоб замісники одержали якомога менші номери.
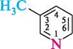
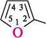
2-метилфуран 3-метилпіридин У п'яти- і шестичленних гетероциклах з одним гетероатомом атоми Карбону іноді позначають грецькими буквами а, (3, у.
Ч а-метилфуран Сн,
у-амінопіридин У гетероциклах з кількома рівноцінними гетероатомами нумерацію проводять таким чином, щоб гетероатоми одержали найменші з можливих номерів:
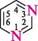
1,3-діазин якщо в гетероциклі є кілька різних гетероатомів, то нумерацію починають з того, який у ряду O, S, NH, N розміщений лівіше; проводять у такому напрямі, щоб інші гетероатоми одержали якомога менші номери:
1,3-оксазол 1,3-тіазол Для деяких гетероциклів існує особливий порядок нумерації. Велику групу складають гетероциклічні сполуки з двома і більше конденсованими циклами. Системи можуть складатися з одного гетероциклічного та одного або кількох бензенових кілець, а також з кількох гетероциклічних ядер. Зазвичай для таких гетероциклів використовують тривіальні назви:
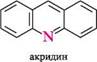
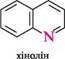
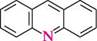
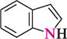
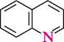
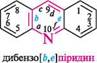
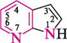
N^N11 ІНДОЛ акридин пурин ГетерОЦиКЛІЧнІ СПОЛУКи Систематичні назви конденсованих гетероциклічних систем утворюють, використовуючи як родоначальні структури тривіальні назви гетероциклів. При побудові назв конденсованих систем, що складаються з одного гетероциклічного та одного або двох бензенових ядер, до назви гетероциклу приєднують префікс бенз- (бензо-) або дибенз- (дибензо-) із указівкою латинськими літерами a, b, c, d і так далі зв'язку гетероциклу, уздовж якого відбувається конденсація. Позначення зв'язків починають від гетероатома:
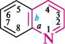
бензо[6]піридин якщо конденсована система складається з двох гетероциклів, за основу назви беруть назву циклу, більшого за розміром; при однаковому розмірі — циклу з більшою кількістю гетероатомів, і, нарешті, якщо за першими двома критеріями цикли рівнозначні, то нітрогеновмісний цикл має перевагу перед оксигеновміс-ним, а останній — перед сульфуровмісним. За допомогою літер указують зв'язок основного циклу, що є спільним для обох циклів, а за допомогою цифр — спільний зв'язок другого циклу з основним:
троло[2,3-й]піридин піридо[2,3-*/]тримідин Глава 31
Три- і чотиричленні гетероциклічні сполуки з одним гетероатомом можна розглядати як похідні циклопропану та циклобутану, в яких угруповання —CH2— заміщене на гетероатом.
7 П ^7 П о і— о ічн і— ічн оксиран оксетан азиридин азетидин ці гетероциклічні сполуки мають низку спільних методів добування і мають подібну реакційну здатність, зумовлену наявністю в структурі напружених три-і чотиричленного кілець. цим пояснюється їх схильність до реакцій приєднання, які проходять з розривом зв'язку гетероатом—Карбон. Тричленні гетероцикли порівняно з чотиричленними менш стійкі і більш реакційноздатні. ОКСИРАН ТА ОКСЕТАН н2с сн2 я2с сн2 о н2с—о оксиран; оксетан; етиленоксид; триметиленоксид епоксиетан 31.1.1. СПОСОБИ ДОБУВАННЯ Спільним способом одержання оксирану та оксетану є циклізація галогено-спиртів. Оксиран і його похідні добувають циклізацією $-галогеноспиртів. Реакція перебігає при дії концентрованих розчинів лугів: Н2С—СН2 + №ОН —► Н2С—СН2 + р-хлоретиловий спирт оксиран Для добування оксетану використовують у-галогеноспирти. СН2—СН2—СН2 + ШОЯ —► Н2С—СН2 у-хлоропропшовий спирт оксетан три- І ЧОтириЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи
н9с=сн, \ / ФІЗИЧНІ ВЛАСТИВОСТІ Оксиран — безбарвний газ з ефірним запахом (т. кип. 10,7°С), добре розчиняється у воді та органічних розчинниках. Оксетан — рідина (т. кип. 47,8°С), добре розчиняється у воді, в етиловому спирті і діетиловом етері. ХІМІЧНІ ВЛАСТИВОСТІ У хімічному відношенні оксиран та оксетан дуже реакційноздатні сполуки. це пов'язано з кутовим і торсійним напруженням циклів (подібно до циклопропану і циклобутану), а також наявністю полярних зв'язків C—O. При дії електрофільних і нуклеофільних реагентів відбувається розрив C—O-зв'язку і приєднання молекули реагенту за місцем розриву циклу. Особливо легко ці реакції проходять за умов кислотного каталізу. Так, у присутності сульфатної або фосфатної кислот оксиран легко приєднує воду та спирти: н2с—сн2 + н2о етиленгліколь н2с—сн2 + с2н5он 2-етоксиетанол; етилцелозольв Механізм наведених реакцій включає утворення оксонієвої сполуки (продукту взаємодії оксирану з кислотою), яка набагато легше піддається атаці нуклеофіль-ним реагентом, ніж сам оксиран (5'+ > 5+): Н\../Н Р. н н н ї н н. рн *н но' н оксонієва сполука етиленгліколь Глава 31 520Г Аналогічним чином оксиран приєднує галогеноводні: н2с—сн2 + неї —► н2с—сн2 2-хлоретанол; етиленхлорогідрин Оксиран досить легко реагує із сильними нуклеофілами — амоніаком, амінами та метал органічними сполуками. При взаємодії оксирану з амоніаком залежно від співвідношення реагентів утворюються моно-, ді- і триетаноламіни: н2с-сн2 н2с-сн2 О еганоламін; 2-аміноетанол НО—СН,—СН,\ Н2СЧ~/СН2 НО—СН2—\ но- сн2- сн/ но- сн2- сн/ діетаналамін триетаноламін Механізм реакції: Н2С—СН2 + Т^-Н ++ Н2С—СН2 —► Н2С—СН2 О5 О"+К^Н ОНИН, ЧН При дії на оксиран аліфатичних амінів утворюються N-алкіламіноетаноли: н2с—сн2 + н2к—к —► но—сн2—сн2—мн—к О М-алиламіноетанол Продукти приєднання магнійорганічних сполук до оксирану легко піддаються гідролізу з утворенням відповідних спиртів: н2с-сн2 \ / II -Ме(ОН)Вг 3 2 2 5 -О СН3 ОМ§Вг пропоксимагнійбромід 1-пропанол У присутності сильних основ оксиран полімеризується з утворенням поліети-леноксиду (поліетиленгліколю): «нх- сн, \ / і- -їй О поліетиленоксид Поліетиленгліколь залежно від молекулярної маси має різний агрегатний стан. Полімер з молекулярною масою 400 є рідиною, добре розчинний у багатьох органічних розчинниках. Використовується у фармації як розчинник лікарських три- І ЧОтириЧЛеннІ ГетерОЦиКЛІЧнІ СПОЛУКи речовин, основа для мазей і супозиторіїв, а також як зв язуюча речовина у виробництві таблеток. Оксетан за хімічними властивостями подібний до оксирану і вступає в характерні реакції приєднання з розкриттям циклу. Проте менший ступінь напруження в чотиричленному циклі сприяє тому, що ці реакції перебігають набагато повільніше. Багато реакцій оксетану приводять до утворення 1,3-дизаміщених пропану: тга, —сн2— сн2— сн2— он З-аміно-1-пропанол
Н2С—О Неї
сі— сн2— сн2— сн2— он З -хлор-1 -пропанол >■ сн3о—сн2— сн2— сн2— он З-метокси-1-пропанол СН3— СН2— СН2— СН2— букжсимагнійбромід І НОН;Н+ СН3—СН2—СН2—СН2—ОН 1-буганол М§(ОН)Вг
Поиск по сайту: |
 О
О



 ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ
ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ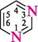



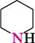


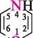

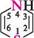
 Знаком (*) відмічено тривіальні назви. Першими наведено найбільш поширені назви.
Знаком (*) відмічено тривіальні назви. Першими наведено найбільш поширені назви.
 4
4

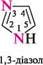
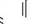

 ТРИ- І ЧОТИРИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ З ОДНИМ ГЕТЕРОАТОМОМ
ТРИ- І ЧОТИРИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ З ОДНИМ ГЕТЕРОАТОМОМ У промисловості оксиран добувають переважно окисненням етилену киснем повітряпри температурі 300—400 °С над срібним каталізатором.
У промисловості оксиран добувають переважно окисненням етилену киснем повітряпри температурі 300—400 °С над срібним каталізатором. н2с—сн2
н2с—сн2 СН3ОН; Н
СН3ОН; Н