|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
АРОМАТИЧНІ АЛЬДЕГІДИ І КЕТОНИ
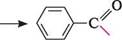
23.4.1. КЛАСИФІКАЦІЯ. НОМЕНКЛАТУРА У ряду ароматичних альдегідів виділяють альдегіди, які містять альдегідну групу в бензеновому ядрі (аренкарбальдегіди), і такі, що містять альдегідну групу в боковому ланцюзі. Найпростішим представником першої групи є бензальдегід, або бензойний альдегід, який дістав назву від кислоти, в яку він перетворюється при окисненні.
бензальдегід; бензойний альдегід
4-метилбензальдегід; и-толуїловий альдегід он 2-гідроксибензальдегід; саліциловий альдегід Альдегіди, що містять функціональну групу в боковому ланцюзі, називають, як і похідні альдегідів жирного ряду. Положення фенільного радикала зазвичай позначають літерами грецького алфавіту:
н
р-фешлпрошоновий альдегід; гідрокоричний альдегід У ряду ароматичних кетонів виділяють чисто ароматичні і жирноароматичні кетони. У молекулі чисто ароматичних кетонів карбонільна група зв'язана з двома ароматичними радикалами. якщо один з радикалів аліфатичний, то такі кетони належать до жирноароматичних. Для назв ароматичних кетонів частіше використовують радикало-функціональну номенклатуру (див. с. 373). широко застосовують також і тривіальні назви: Глава 23
дифенілкетон; бензофенон металфенілкетон; ацетофенон О бензилфенілкетон СПОСОБИ ДОБУВАННЯ Методи синтезу ароматичних і аліфатичних альдегідів та кетонів багато в чому подібні. Для добування ароматичних карбонілвмісних сполук використовують: окиснення первинних і вторинних ароматичних спиртів, омилення гемінальних дигалогенопохідних вуглеводнів, піроліз кальцієвих солей карбонових кислот та інші способи. Існує низка специфічних методів для синтезу ароматичних альдегідів та кетонів. Окиснення ароматичних вуглеводнів.Пряме окиснення толуену або інших похідних, що містять метильну групу, зв'язану з бензеновим кільцем (метиларенів), приводить до відповідного альдегіду. як окисники можуть бути використані хром(VI) оксид, ванадій(V) оксид, манган(IV) оксид тощо. Окиснення хром(VI) оксидом проводять у середовищі оцтового ангідриду. Утворений у процесі окиснення ацилаль (естер гідратної форми альдегіду) не піддається наступному окисненню, а в результаті його подальшого гідролізу з високим виходом одержують альдегід:
СЮ3; (СН3СО)2О
НС /ОСОСН3 ОСОСН, Н2О; Н+
ацилаль; геи-діацетат бензальдегід Окиснення ароматичних вуглеводнів з метою добування альдегідів використовують не тільки в хімічній лабораторії, але й у промисловості. реакція Гаттермана — Коха.Метод ґрунтується на прямому введенні альдегідної групи в бензенове ядро. цю реакцію також називають реакцією формілювання. Формілювання ароматичних вуглеводнів проводять сумішшю карбон(II) оксиду і хлороводню в присутності алюміній хлорид і купрум(I) хлориду:
СН, со + неї
Сн,
толуен и-толуїловий альдегід Реакція здійснюється тільки з порівняно активними аренами, використовується для добування алкіл- і галогенозаміщених ароматичних альдегідів. Бензальдегід в умовах цієї реакції утворюється з незначним практичним виходом. АЛЬДеГІДи. КетОни реакція Фріделя — Крафтса.Основним методом добування ароматичних кетонів є ацилювання ароматичних вуглеводнів за Фріделем — Крафтсом. як ацилюючі реагенти найчастіше використовують галогенангідриди або ангідриди карбонових кислот:
СІ -неї о Ацетофенон неї Реакція проходить за механізмом SE (див. с. 203). ФІЗИЧНІ ВЛАСТИВОСТІ Ароматичні альдегіди та кетони — це рідини або тверді речовини (табл. 23.4), нерозчинні у воді. Ароматичні альдегіди мають запах гіркого мигдалю, з видаленням альдегідної групи від бензенового ядра запах стає різкішим. Кетонам властиві досить приємні запахи. Таблиця 23.4 Фізичні характеристики ароматичних альдегідів та кетонів
Сполука Назва Температура, °С
Густина, d4
,0 н Бензальдегід -26,0 179,2 1,0447 (4°
чн о-Толуїловий альдегід 195,5 1,0386 (d19)
сн, н м-Толуїловий альдегід 199,0 1,0189 (d21)
п-Толуїловий альдегід 205,0 1,0194 (d4
Ацетофенон 19,7 202,3 1,0281 (А20)
48,1 306,0 1,0976 (d50) Глава 23
Людвіг ГАТТЕРМАН (1860-1920) Німецький хімік-органік. Основні наукові праці присвячені синтетичній органічній хімії. Відкрив (1890) реакцію обміну діазогрупи в ароматичних солях діазонію на атом галогену або ці-аногрупу в присутності металічної міді (реакція Гаттермана). Спільно зі своїм співпрацівником Й. А. Кохом розробив (1897) метод одержання ароматичних альдегідів, який ґрунтується на формі-люванні ароматичних вуглеводнів під дією карбон(ІІ) оксиду і хлороводню в присутності кислот Льюїса. Відкрив (1898) формілювання фенолів та їх етерів. Автор підручника «Практичні роботи з органічної хімії» (1894). ХІМІЧНІ ВЛАСТИВОСТІ Хімічні властивості ароматичних альдегідів та кетонів багато в чому подібні до властивостей альдегідів та кетонів жирного ряду. Ароматичні альдегіди дають реакцію «срібного дзеркала», утворюють ацеталі, ціангідрини, гідросульфітні сполуки, альдоксими, гідразо-ни, азометини. Однак ароматичні альдегіди не вступають у реакцію альдольної конденсації, дуже важко полімеризуються, в інших співвідношеннях взаємодіють з амоніаком. Ароматичні кетони порівняно з кетонами жирного ряду мають меншу реакційну здатність. Тому вони не утворюють гідро-сульфітних сполук, бензофенон не реагує з ціанідною кислотою. Ароматичні альдегіди і кетони виявляють низку специфічних властивостей. Взаємодія з амоніаком.Ароматичні альдегіди вступають у взаємодію з амоніаком у співвідношенні 3 : 2 з утворенням гідробензаміду:
гідробензамід Утворений у процесі реакції імін бензальдегіду не здатний полімеризуватися, дві його молекули вступають у реакцію з третьою молекулою бензальдегіду. реакція Канніццаро.Відкрита 1853 року італійським ученим Станіслао Канніц-царо. У присутності сильної основи або концентрованого лугу ароматичні альдегіди вступають у реакцію диспропорціювання. При цьому одна з двох молекул альдегіду окиснюється до відповідної кислоти, а інша — відновлюється до спирту:
калієва сіль бензойної кислоти бензиловий спирт аЛЬДеГІДи. КетОни
Реакція перебігає з переносом гідридного іона (Н~). У реакцію Канніццаро вступають також деякі альдегіди жирного ряду, зокрема формальдегід, і альдегіди, які не містять атомів Гідрогену при а-атомі Карбону:
О + СН3—ОН
ОК
Поиск по сайту: |



 ,0
,0




 -2СН-СООН
-2СН-СООН

 А1С13; СиСІ
А1С13; СиСІ


 плавлення
плавлення

 сн,
сн, ло
ло
 с—сн,
с—сн,



 ок
ок