 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
НОМЕНКЛАТУРА. ІЗОМЕРІЯ. У номенклатурі альдегідів і кетонів використовують тривіальні та систематичні
У номенклатурі альдегідів і кетонів використовують тривіальні та систематичні назви. Тривіальні назви альдегідів походять від назв кислот, на які вони перетворюються при окисненні. Альдегід, при окисненні якого одержують мурашину (форміатну) кислоту, називають мурашиний альдегід, або формальдегід (від лат. асійит formicum); альдегід, при окисненні якого утворюється оцтова (ацетатна) кислота,— оцтовий альдегід, або ацетальдегід (від лат. acidum aceticum) і т. д. За замісниковою номенклатурою ШРАС назви альдегідів утворюють від назви вуглеводню з такою ж самою кількістю атомів Карбону (включаючи атом Карбону альдегідної групи) з додаванням суфіксу -аль. Нумерацію головного вуглецевого ланцюга починають з атома Карбону альдегідної групи. Приклади назв альдегідів за тривіальною та замісниковою номенклатурами наведені в табл. 23.1. Нерідко в назвах альдегідів положення замісників указують грецькими літерами а, |3, у і т. д. (літерою а позначають атом Карбону, сусідній з альдегідною групою): 8 у Р а Х^ у Р а /Р сн3— сн2—сн2— сн—сч сн2— сн2—сн2—сч СН3 Н Вг Н А-метилвалеріановий альдегід у-бромомасляний альдегід
чн аЛЬДеГІДи. КетОни Таблиця 23.1 Назви альдегідів аліфатичногоряду
Для назв кетонів широко використовують радикало -функціональну номенклатуру, за якою до назв (в алфавітному порядку) замісників вуглеводневих радикалів при карбонільній групі додають суфікс -кетон: сн3—сн2—с—сн3 о Етилметилкетон При утворенні назв кетонів за замісниковою номенклатурою обирають найдовший вуглецевий ланцюг, до складу якого входить кетогрупа. Нумерацію здійснюють так, щоб атом Карбону карбонільної групи отримав якомога менший номер. Потім до назви насиченого вуглеводню, який містить таку ж саму кількість атомів Карбону, додають суфікс -он і цифровий локант, що позначає атом Карбону кетогрупи: сн3—сн— сн2— с—сн3
сн. 4-метил-2-пентанон сн3—сн— с—сн2—сн3 сн3 о Метил-З-пентанон Глава 23 Для деяких кетонів збереглися тривіальні назви. Диметилкетон частіше називають ацетоном. Приклади назв кетонів за радикало-функціональною та замісни-ковою номенклатурами наведені в табл. 23.2. Таблиця 23.2 Назви кетонів аліфатичного ряду
Для карбонільних сполук характерна структурна ізомерія. Альдегіди та кетони, які містять однакову кількість атомів Карбону, ізомерні між собою. Так, пропанон
СН3—С—СН3 і пропаналь СН3—СН2—С є структурними ізомерами (ізоме- н О рами функціональної групи). Ізомерія альдегідів і кетонів може бути пов'язана з різною структурою вуглецевого ланцюга: сн3— сн2— сн2— Масляний альдегід ,0 чн сн3—сн— сн3 Ізомасляний алвдегід ,0 н
сн3—сн2— сн2— с—сн3 о Пентанон сн3—сн—с—сн3 сн3 о З -метилбутанон Для кетонів характерна також ізомерія, зумовлена положенням карбонільної групи: сн3—сн2— сн2— с—сн3 о сн3—сн2— с—сн2— сн3 о
Пентанон Пентанон АЛЬДеГІДи. КетОни СПОСОБИ ДОБУВАННЯ Окиснення спиртів.Первинні спирти окиснюються до альдегідів, а вторинні — до кетонів (див. с. 328). к—сн2—он н он 2 о Гідратація алкінів (реакція Кучерова) (див. с. 170, 171). Вумовах реакції Куче-рова з ацетилену утворюється ацетальдегід, з гомологів ацетилену — кетони: 2+ нс=сн + н2о н н2о о Гідроліз гемінальних дигалогеналканів.При гідролізі гем-дигалогеналканів з атомами галогену при первинному атомі Карбону утворюються альдегіди, а при вторинному — кетони: СН3—СН2—СН ----—► СН3—СН2—С + 2НС1 чсі н 1,1-дихлоропропан пропіоновий алвдегід СН3— С— СН3 а хсі о 2,2-дихлоропропан ацетон Піроліз солей карбонових кислот.При піролізі (термічний розклад) кальцієвих, барієвих або торієвих солей карбонових кислот утворюються відповідні карбонільні сполуки. Зі змішаної солі мурашиної та іншої карбонової кислоти добувають альдегіди, а в решті випадків утворюються кетони: сн3-с( о о >,зоо °с # Са ---------- ► СН3— С + СаСО3 ,0 н-с о Глава 23 ,0
о
СН3—С—СН3 О сн3-с( О Озоноліз алкенів.При взаємодії алкенів з озоном утворюються озоніди — циклічні пероксидні сполуки, які легко розщеплюються цинком в оцтовій кислоті з утворенням альдегідів або кетонів: х> о-Ьо х>»
О, \ / і \ /
—-+■ С ■■"'- С
К О чн алкен озонід Оксосинтез (гідроформілювання). У промисловості альдегіди отримують взаємодією алкенів з карбон(II) оксидом і воднем при підвищеній температурі і тиску в присутності платинового, нікелевого або кобальтового каталізаторів. Зазвичай утворюється суміш ізомерів: СР
2К—СН = СН2 н ^о н ^о ФІЗИЧНІ ВЛАСТИВОСТІ Формальдегід (мурашиний альдегід) — газ, нижчі альдегіди і кетони — леткі рідини (табл. 23.3). Киплять вони при нижчій температурі, ніж відповідні спирти, тому що не здатні утворювати водневі зв'язки. Температури кипіння кетонів дещо вищі, ніж в ізомерних до них альдегідів. Альдегіди і кетони добре розчиняються в органічних розчинниках, зокрема нижчі представники — розчинні у воді. Більшість альдегідів і кетонів мають характерний запах. Таблиця 23.3 Фізичні характеристики альдегідів та кетонів
аЛЬДеГІДи. КетОни Закінчення табл. 23.3
ХІМІЧНІ ВЛАСТИВОСТІ Хімічні властивості альдегідів та кетонів визначаються наявністю в їх молекулі карбонільної групи, будову якої зображено на рис. 23.1.
120° Рис. 23.1. Будова карбонільної групи Глава 23 Атом Карбону карбонільної групи знаходиться в стані sp2-гібридизації і зв'язаний з оточуючими його атомами трьома с-зв'язками, розташованими в одній площині під кутом 120°. Негібридизована р-орбіталь атома Карбону перекривається з р-орбіталлю атома Оксигену, утворюючи я-зв'язок. Атом Оксигену як більш електронегативний елемент притягує до себе о- і я-електрони (останні більш рухливі, тому що значно слабше утримуються ядрами). Унаслідок цього подвійний зв'язок карбонільної групи сильно поляризований, на атомі Оксигену виникає частковий негативний заряд, а на атомі Карбону — частковий позитивний: .0=0 . Завдяки такій поляризації альдегіди та кетони здатні вступати в реакцію з нуклеофільними реагентами, які атакують атом Карбону карбонільної групи. Альдегіди, як правило, більш реакційноздатні за кетони. Алкільні радикали за рахунок +I-ефекту зменшують частковий позитивний заряд на атомі Карбону карбонільної групи. Наявність у молекулі кетону двох алкільних груп при карбонільному угрупованні призводить до більшого зниження часткового позитивного заряду, порівняно з молекулою альдегіду. Крім того, алкільні радикали в молекулі кетону більше заважають підходу нуклеофілу до карбонільної групи. к>с к-^сх-К' н <&- 8+ > 5'+ Поряд з реакціями, які перебігають за участі карбонільної групи, для альдегідів та кетонів характерні також перетворення по а-атому Карбону. Виходячи з вище-наведеного, реакції альдегідів та кетонів умовно можна розділити на такі групи: > нуклеофільного приєднання; > приєднання — відщеплення; > конденсації; > за участі а-атома Карбону; > полімеризації; > окиснення і відновлення. РЕАКЦІЇ НУКЛЕОФІЛЬНОГО ПРИЄДНАННЯ (AN) До реакцій AN альдегідів та кетонів належать: приєднання ціанідної кислоти, натрій гідросульфіту, води, спиртів, взаємодія з магнійорганічними сполуками. Ну-клеофільне приєднання починається з атаки нуклеофілом електронодефіцитного атома Карбону карбонільної групи. Нуклеофілом можуть бути іони або нейтральні частинки. Приєднання ціанідної кислоти.ціанідна (синильна) кислота приєднується до карбонільних сполук, утворюючи ціангідрини, або и-гідроксинітрили:
сн3-сн-ск І он ацеталвдегід нітрил а-пдрокси- пропіонової кислоти аЛЬДеГІДи. КетОни
СН3—СН2—С —СN ОН нітрил ех-гідрокси-а-метилмасляної кислоти Реакція проходить у присутності основи, нуклеофілом є ціанід-іон: хсА> + стг +± ;с( ціангідрин Утворені ціангідрини можна легко гідролізувати до відповідних а-гідроксикислот, а також для подовження вуглецевого ланцюга цукрів. Приєднання натрій гідросульфіту. Альдегіди і метилкетони реагують з натрій гідросульфітом (бісульфітом), утворюючи гідросульфітні сполуки — а-гідроксисульфо-нати. Кетони більш складної будови в реакцію не вступають. Взаємодія відбувається без каталізатора, тому що гідросульфіт-іон — досить сильний нуклеофіл: К—С* + :8^ОН —► К —С — Н ОМа+ І Г1 гідросульфітна сполука; натрій а-гідроксиалкансульфонат ОН /> /> І К—С + :§^ОН —► К — С — СН3 гідросульфітна сполука Гідросульфітні сполуки погано розчиняються у воді і виділяються у вигляді кристалічного осаду. Нагрівання з водним розчином мінеральної кислоти або натрій карбонату приводить до їх руйнування з виділенням вільного альдегіду або кетону. Реакція з натрій гідросульфітом є якісною на карбонільну групу, а також використовується для виділення та очищення альдегідів і кетонів. Приєднання води. Розчинення альдегідів у воді супроводжується утворенням гідратів, які є продуктами приєднання молекули води по карбонільній групі. як правило, гідрати альдегідів нестійкі. У водних розчинах вони перебувають в динамічній рівновазі з альдегідом: + нон :«=► к—с—о—н гідратна форма альдегіду; гем-діол Глава 23 Положення рівноваги визначається будовою карбонільних сполук. Формальдегід у воді практично повністю гідратований, ацетальдегід — наполовину, а ацетон — практично не взаємодіє з водою. Гідрати альдегідів існують лише в розчині і виділити їх неможливо; при перегонці вони розкладаються. Існування гідратів доводять за допомогою фізичних методів дослідження. У деяких випадках, коли карбонільна група зв'язана із сильним електроноак-цепторним замісником, можна виділити гідрат, який утворився, у вільному вигляді. Трихлорацетальдегід (хлораль), приєднуючи молекулу води, перетворюється в хлоральгідрат, який є стійкою кристалічною речовиною: ? /шсі— с-«-~сг + нон —► сі— с-«-сн а н а Х°н хлораль хлоральгідрат Відокремити воду від хлоральгідрату вдається тільки дією сульфатної кислоти. Хлоральгідрат використовується в медичній практиці як заспокійливий і проти-судомний засіб. Приєднання спиртів.При взаємодії альдегідів зі спиртами утворюються напівацеталі, а в присутності слідів мінеральних кислот — ацеталі.
К—С^ + К'—ОН н напівацеталь Напівацеталі здебільшого малостійкі. Винятком є циклічні напівацеталі, які утворюються самовільно з у- і 5-гідро-ксиальдегідів:
5-гідрокси- циклічний валеріановий альдегід напівацеталь Напівацеталі при подальшій взаємодії з другою молекулою спирту перетворюються в ацеталі:
к —с —ок' + н2о н ацеталь Ацеталі стійкі в лужному середовищі, але легко гідролізуються до вільного альдегіду в розведених кислотах. Така властивість ацеталів використовується в органічному синтезі для захисту альдегідної групи. аЛЬДеГІДи. КетОни Кетони через низьку реакційну здатність і просторові перешкоди зі спиртами не взаємодіють, тому кеталі добувають, використовуючи інші синтетичні методи. Взаємодія з магнійорганічними сполуками.Альдегіди та кетони реагують з алкіл -і арилмагнійгалогенідами (реактиви Гриньяра) з утворенням продуктів приєднання по карбонільній групі, які гідролізуються в присутності розведених мінеральних кислот до спиртів: з сн3—с н ацеталвдегід 8- 8+ етилмагній-бромід ОМ§Вг сн3—с —с2н5 н бромомагній алкоголят НОН:Н+ -Ме(ОН)Вг ОН сн3—с —с2н, н 2-бутанол; вдіор-бутиловий спирт
5 116+ ацетон 8— 8+ ОМ§Вг СН3-С-С2Н5 сн3 ОН СН3-С-С2Н5 сн3 2-метил-2-бутанол; третя-аміловий спирт З формальдегіду утворюється первинний спирт, усі інші альдегіди дають вторинні спирти, а кетони — третинні. Реакція приєднання магнійорганічних сполук до альдегідів і кетонів є одним з важливих способів добування спиртів. РЕАКЦІЇ ПРИЄДНАННЯ - ВІДЩЕПЛЕННЯ Альдегіди та кетони взаємодіють з N-нуклеофілами (Н2—X, де Х = —Н, —Аlk, —Аr, —ОН, —NН2 тощо) з утворенням нестійких продуктів нуклеофіль-ного приєднання, які стабілізуються завдяки відщепленню молекули води. ця група реакцій отримала назву «реакції приєднання — відщеплення». Взаємодія з амоніаком.Альдегіди, приєднуючи молекулу амоніаку, утворюють альдіміни. У процесі реакції спочатку утворюється нестійкий аміноспирт, від якого потім відщеплюється молекула води. Механізм реакції: СН3— У - н о СН3— С— №І3 Н І ОН СН3— С —
СН3— С — її СН3—СН= ацетальдімін; етанімін; азометан Н2О За аналогічним механізмом перебігають реакції з іншими N-нуклеофілами. Глава 23 382Г Альдіміни — нестійкі сполуки, вони спонтанно циклотримеризуються з утворенням альдегідамоніаку: СН3 зсн3—сн=>ш—►^ ? н3с ^ сн3 н алвдегідамоніак Кетони також взаємодіють з амоніаком, але при цьому утворюються продукти більш складної будови. Взаємодія з первинними амінами.Альдегіди та кетони реагують з первинними амінами з утворенням N-заміщених імінів (азометинів) (див. с. 294). \:=о + н2м—к ;«=► \:=м— к + н2о альдегід амін К-заміщений імін; або кетон азометан Кетони реагують повільніше, ніж альдегіди. N-Заміщені іміни, які містять у своїй структурі хоча б один арильний радикал, відрізняються значною стійкістю; їх називають основами Шиффа. Взаємодія з гідроксиламіном.Продукти конденсації альдегідів та кетонів з гідро-ксиламіном називають альдоксимами і кетоксимами:
Н к—с—к' + н2>т—он ^=*г к—с—к' + н2о кетоксим Альдоксими і кетоксими — кристалічні речовини з чіткою температурою плавлення. У кислому середовищі вони легко гідролізуються з утворенням вихідних продуктів. Тому реакцію утворення оксимів використовують для виділення та ідентифікації альдегідів і кетонів. Взаємодія з гідразином і його похідними.Альдегіди та кетони реагують з гідразином Н2И—НН2 і його похідними — фенілгідразином С6Н5—ЇЧН—, семі- карбазидом НуК—1ЧН—С—1ЧН,, тіосемікарбазидом Н^—]ЧН—С—ІЧН, О 8 з утворенням гідразонів, семікарбазонів і тіосемікарбазонів відповідно: АЛЬДеГІДи. КетОни
гідразон
:=іч—N11—с6н5 С= О фешлгідразон
:=N—NН—С—NN3
семікарбазон :=N—NН—С — ііосемікарбазон 8 Продукти цих реакцій, подібно до оксимів, добре кристалізуються і використовуються для відкриття альдегідів та кетонів, а також виділення їх із сумішей. При взаємодії з гідразином карбонільні сполуки, нарівні з гідразонами, утворюють азини: 2 \:=о К' К' =И— N=0
К' + 2Н2О РЕАКЦІЇ КОНДЕНСАЦІЇ альдольна конденсація.Альдегіди, які містять атоми Гідрогену при а-атомі Карбону, у присутності каталітичних кількостей основи здатні вступати в реакцію альдольної конденсації. Взаємодія здійснюється за участі рухливого а-атома Гідрогену однієї молекули і карбонільної групи іншої молекули альдегіду та приводить до утворення сполуки зі спиртовою та альдегідною групами (альдоль). ?н
р-гідроксимасляний алвдегід; 3-гідроксибуганаль У слабколужному середовищі гідроксид-іон відщеплює протон від а-атома Карбону альдегіду з утворенням спряженого енолят-аніона:
сно=с енолят-аніон \ О" н енолят-аніон має сильні нуклеофільні властивості й атакує атом Карбону карбонільної групи другої молекули альдегіду з утворенням альдолю: Глава 23
нон.
+ ОН"
Поиск по сайту: |
 1 У складі формальдегіду Н—С карбонільна група зв'язана з двома атомами Гідрогену.
1 У складі формальдегіду Н—С карбонільна група зв'язана з двома атомами Гідрогену.
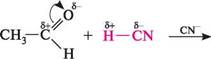

 сн3
сн3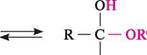



 -н2о
-н2о
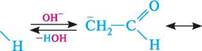 с*>
с*>