 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ГаЛОГенОПОхІДнІ ВУГЛеВОДнІВ. хлористий вініл 1,1-дихлоретан
н2с=сн—сі + неї хлористий вініл 1,1-дихлоретан У присутності каталізаторів вінілгалогеніди легко вступають у реакції полімеризації, які широко використовуються у виробництві полімерних матеріалів: = СН —СІ --сн,—сн--
СІ полівінілхлорид У молекулах алілгалогенідів, на відміну від вінілгалогенідів, атом галогену має підвищену рухливість. Алілгалогеніди вступають у реакції нуклеофільного заміщення легше, ніж галогеналкани. Заміщення, як правило, відбувається за механізмом SN1. Висока активність алілгалогенідів у реакціях нуклеофільного заміщення пояснюється їх схильністю до іонізації, оскільки при цьому утворюється досить стійкий алільний катіон: Н2С = СН —СН2—Вг н2с=сн—сн2 Вг" Стабільність алільного катіона зумовлена делокалізацією позитивного заряду по кон'югованій системі:
Унаслідок електроноакцепторного впливу атома галогену реакційна здатність подвійного зв'язку в алілгалогенідах трохи нижча, ніж у відповідних алкенах, однак приєднання галогеноводнів проходить за правилом Марковникова:
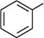
неї —► сн3—сн—сн2 СІ СІ алілхлорид 1,2-дихлоропропан АРОМАТИЧНІ ГАЛОГЕНОВУГЛЕВОДНІ Ароматичними галогеновуглеводнями називають похідні ароматичних вуглеводнів, в яких один або кілька атомів Гідрогену заміщені атомами галогенів. Залежно від положення атомів галогену ароматичні галогеновуглеводні поділяють на дві групи: > галогенарени — сполуки, в яких атоми галогену безпосередньо зв'язані з ароматичним ядром:
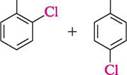
о-бромотолуен а -бромонафтален Глава 18 > арилалкілгалогеніди — сполуки, які містять атоми галогену в боковому вуглецевому ланцюзі:
СІ 1-фенил- 1-хлоретан СПОСОБИ ДОБУВАННЯ Для добування галогенаренів найчастіше використовують два методи. Пряме галогенування ароматичних вуглеводнів(див. с. 201). Реакція проходить за механізмом SЕ. У надлишку галогену утворюються ди- і тригалогенарени:
СІ СІ СІ
2С12; РеС13 -2НС1 хпоробензен о-дихлоробензен и-дихлоробензен Заміщення діазогрупи в солях арилдіазонію на атом галогену (реакція Зандмейєра, див. с. 307):
+ ]ЧГ2Ї бензендіазоній хлорид хлоробензен Для введення атома галогену в боковий вуглецевий ланцюг аренів застосовують такі методи, як галогенування алкіларенів і реакцію хлорометилювання.
Галогенування алкіларенів.На відміну від галогенування в ароматичне ядро, галогенування в боковий ланцюг відбувається без каталізатора при високих температурах або при УФ-опроміненні. Реакція перебігає за механізмом SR (див. с. 133):
толуен бензилхлорид бензиліденхлорид бензилідинхлорид Галогенування в боковий ланцюг іде, як правило, в а-положення відносно бензенового ядра, оскільки в цьому разі утворюється стійкий вільний радикал бензильного типу (див. с. 124):
сі2 ЛУ. СН3 СІ 1-феніл-1-хлоретан НС1 У надлишку галогену всі атоми Гідрогену при а-атомі Карбону в молекулі можуть бути заміщені на атоми галогену. ГаЛОГенОПОхІДнІ ВУГЛеВОДнІВ реакцію хлорометилювання використовують для одержання арилметилхлоридів. Вона ґрунтується на взаємодії аренів з формальдегідом і хлороводнем у присутності каталізатора (AlCl3, ZnCl2). У процесі реакції атом Гідрогену бензенового кільця заміщується на хлорометильну групу:
^ 2ПС12 ^ч/*** з—с( + неї —-+ + н2о н ^-^ формалвдегід бензилхлорид Хлорометилювання належить до реакцій електрофільного заміщення в ароматичному ряду. Атакуючою електрофільною частинкою є гідроксиметил-катіон CH2OH:
СН2ОН ^\ /СНХ1
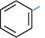
НС1; 2пС12 -н2о *■ Для добування ароматичних галогеновуглеводнів з атомами галогену в боковому ланцюзі придатні всі способи одержання галогенопохідних аліфатичного ряду. ФІЗИЧНІ ВЛАСТИВОСТІ Галогенопохідні бензолу та його гомологів — це рідини або кристалічні речовини. Температури кипіння галогенаренів зростають у ряду: флуоро-, хлоро-, бромо-, йодопохідні. Усі сполуки цього ряду нерозчинні у воді, але легко розчиняються в органічних розчинниках. Арилалкілгалогеніди з атомами галогену в а-положенні бокового ланцюга, маючи подразнюючу дію на слизові оболонки, викликають сльозотечу. ХІМІЧНІ ВЛАСТИВОСТІ Для ароматичних галогеновуглеводнів характерні реакції нуклеофільного заміщення (SN) за участю зв'язку C—Hal, реакції електрофільного заміщення (SE) по ароматичному ядру і реакції з металами (металювання). РЕАКЦІЇ НУКЛЕОФІЛЬНОГО ЗАМІЩЕННЯ (SN) Галогеновуглеводні, які містять атом галогену, безпосередньо зв'язаний з бензеновим кільцем, характеризуються низькою реакційною здатністю зв'язку С—Hal. Атом галогену в цих сполуках малорухливий і заміщується дуже важко. У цьому відношенні галогенарени подібні до вінілгалогенідів.
Глава 18 Унаслідок кон'югації відбувається укорочення або зменшення полярності зв'язку С—Hal, що приводить до його зміцнення. Тому нуклеофільне заміщення атома галогену в галогенаренах відбувається лише за дуже жорстких умов.
Так, у молекулі хлоробензену атом Хлору заміщується на гідроксильну групу під дією концентрованого розчину лугу при температурі понад 300 °С і тиску 150 атм: .СІ 300 °С
хлоробензен фенол Реакція з амоніаком відбувається при температурі 200 °С в присутності каталізатора — порошку міді або солей одновалентного Купруму (реакція Ульмана):
Си; 200 °С
+ 2ІЧН, анілін хлоробензен
Разом з тим рухливість атома галогену в галогенаренах різко зростає за наявності в орто- або пара-положеннях відносно атома галогену сильних електро-ноакцепторних замісників (—NO2, —NO, —CN, —COOH, —SO3H тощо). Такі сполуки називають активованими гало-генаренами. Підвищення реакційної здатності зв'язку C—Hal в активованих галогенаренах пов'язане зі збільшенням часткового позитивного заряду на атакованому атомі Карбону під дією електроноакцепторного замісника. Так, у молекулі 2,4-динітро-1-хлоробензену атом Хлору досить легко заміщується на групи —ОН, —NH2, —OCH3 тощо: ОН
2,4-динітро-1-хлоробензен 2№ї3; 200 °С -ічн4а сн3ок
N02
2,4-динітрофенол N0^ 2,4-динітроашлін
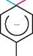
осн, N02 1 -метокси-2,4-динітробензен ГаЛОГенОПОхІДнІ ВУГЛеВОДнІВ Реакції нуклеофільного заміщення активованого атома галогену перебігають за механізмом SN2. Однак на відміну від реакцій SN2 в аліфатичному ряду, які проходять в одну стадію і супроводжуються синхронними процесами розриву зв'язку С—Hal і утворення зв'язку C—Nu, бімолекулярне нуклеофільне заміщення в ароматичному ряду відбувається в дві стадії. На стадії I атакуюча нуклеофільна частинка приєднується до електрофільного атома Карбону, зв'язаного з атомом галогену, утворюючи карбаніон (с-комплекс). електроноакцепторні групи в складі карбаніона беруть участь у делокалізації негативного заряду і тим самим підвищують його стійкість. Cтадія I проходить повільно і лімітує швидкість усього процесу. На стадії II реакції карбаніон відщеплює галогенід-іон з утворенням продукту заміщення:
Стадія І N0, + ОН
СІ ОН
N N о* \> о" V
Стадія II Сі он
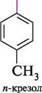
N0, швидко он N0, ст-комплекс + сг На відміну від реакцій SN2 в аліфатичному ряду, при бімолекулярному нуклео-фільному заміщенні в ароматичному ряду процеси утворення зв'язку C—Nu і розриву зв'язку C—Hal відбуваються несинхронно, оскільки новий зв'язок утворюється раніше, ніж розривається старий. якщо атом галогену в галогенарені не активований електроноакцепторною групою, то при нуклеофільному заміщенні атакуюча частинка не завжди займає місце галогену. Так, при лужному гідролізі n-хлоротолуену утворюється еквімо-лярна суміш двох ізомерних продуктів — мета- і пара-крезолів:
и-хлоротолуен 2№0Н; 340 °С ОН ОН Сн, л-крезол При взаємодії калій аміду KNH2 з міченим 1- 14С-хлоробензеном утворюється майже рівна кількість аніліну, міченого в положеннях 1 і 2: Глава 18
ІШН2; (рідк.) хлоробензен Усі ці факти можна пояснити з позицій так званого аринового механізму взаємодії. За цим механізмом заміщення атома галогену на нуклеофіл іде не прямо, а через попереднє відщеплення галогеноводню і наступне приєднання нуклеофілу. Спочатку нуклеофільний реагент, будучи сильною основою, відщеплює від молекули галогенарену галогеноводень, утворює нестійкий, досить реакційноздатний проміжний продукт — дегідробензен (арин), що містить у своєму складі потрійний зв'язок. Потім дегідробензен миттєво приєднує за місцем потрійного зв'язку нуклеофільний реагент, причому ковалентний зв'язок з нуклеофілом може утворити однаковою мірою кожний із двох зв'язаних потрійним зв'язком атомів Карбону:
СІ + N1^ + СГ хлоробензен дегідробензен; арин
+ N11 цей механізм називають ще механізмом елімінування—приєднання. Ароматичні галогеновуглеводні з атомом галогену в боковому ланцюзі легко вступають у різні реакції нуклеофільного заміщення. Сполуки, в яких атом галогену ізольований від бензенового кільця двома і більше вуглець-вуглецевими зв'язками, за активністю в реакціях SN нагадують галогеналкани. Галогеновуглеводні, які містять атом галогену при а-атомі Карбону бокового ланцюга (бензил-галогеніди), мають підвищену реакційну здатність зв'язку С—Hal. За активністю в реакціях SN бензилгалогеніди подібні до алілгалогенідів. Нуклеофільне заміщення атома галогену відбувається в них за механізмом SN1. Висока рухливість атома галогену в бензилгалогенідах зумовлена більшою стійкістю бензильного катіона, який утворюється після відщеплення галогенід-іона (див. с. 119). РЕАКЦІЇ ЕЛЕКТРОФІЛЬНОГО ЗАМІЩЕННЯ В АРОМАТИЧНОМУ ЯДРІ (SE) За участі ароматичного ядра галогенарени вступають у реакції електрофільного заміщення: галогенування, нітрування, сульфування тощо. як уже зазначалося, атом галогену, безпосередньо зв'язаний з ароматичним кільцем, виявляє негативний індуктивний і позитивний мезомерний ефекти, причому в статичному стані -I-ефект > +М-ефекту. Тому атоми галогену в цілому виявляють електроноак-цепторні властивості відносно бензенового кільця і тим самим знижують його реакційну здатність у реакціях SЕ. Беручи участь у стабілізації с-комплексш, які утворюються при заміщенні в орто- і пара-положеннях, атоми галогенів виступа-
Поиск по сайту: |
 СН2
СН2 СН
СН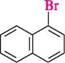

 бензилхлорид
бензилхлорид

 XI
XI

 СН2С1
СН2С1


 + Н—СІ ^ СН2ОН + Сґ
+ Н—СІ ^ СН2ОН + Сґ
 Низька активність зв'язку C—Hal у галогенаренів, як і у вінілгалогенідів, зумовлена взаємодією неподіленої пари електронів атома галогену з я-електронною системою бензе-+м-ефект нового кільця (/>,л-кон'югація).
Низька активність зв'язку C—Hal у галогенаренів, як і у вінілгалогенідів, зумовлена взаємодією неподіленої пари електронів атома галогену з я-електронною системою бензе-+м-ефект нового кільця (/>,л-кон'югація).


 .СІ
.СІ
 №ОН(Н2О); 100 °С.
№ОН(Н2О); 100 °С. -N801
-N801

 -ксі
-ксі










 Стадія II
Стадія II