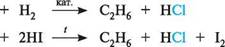|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ГаЛОГенОПОхІДнІ ВУГЛеВОДнІВ. Вторинні і третинні галогеналкани з аргентум нітритом AgNO2 в умовах реакції SN1
СН,Ч СНзЧ 3;сн—Вг + а§ко2 —► )сн—о—N=0 + а§Вгі ізопропілнітрит Взаємодіяіз солями галогенідних кислот(реакція Фінкельштейна). ця реакція дозволяє замінити в молекулі галогеналкану один атом галогену іншим. Взаємодія галогенів із солями галогенідних кислот — процес оборотний. Для зсуву рівноваги вправо використовують різну розчинність вихідних речовин і продуктів реакції. Реакція має практичне значення для одержання первинних флуор- і йодалканів з більш доступних хлоро- і бромопохідних. Для одержання йодидів реакцію проводять в ацетоні, тому що натрій йодид розчинний в ацетоні, а NaCl або NaBr, які утворюються в процесі взаємодії, випадають в осад: с2н5—сі + ші Взаємодія з гідросульфідами і сульфідами лужних металів.При дії на первинні і вторинні галогеналкани гідросульфідів лужних металів утворюються тіоспирти (меркаптани), при дії сульфідів — тіоетери. С2Н5—І + №8Н—► С2Н5—8Н + №1 етантіол 2С2Н5—І+ Ка28—► С2Н5—8—С2Н5+ 2№І діетилсульфід РЕАКЦІЇ ЕЛІМІНУВАННЯ (Е) Кожний реагент, що містить атом з неподіленою парою електронів або негативним зарядом, нарівні з нуклеофільними виявляє також і основні властивості (див. с. 93). Отже, він здатний не тільки надавати пари електронів для утворення зв'язку з електрофільним атомом Карбону, але і відщеплювати від молекули, яка має рухливі атоми Гідрогену, протон Н+. У молекулі галогеналкану набувають рухливості атоми Гідрогену при Р-атомі Карбону внаслідок —I-ефекту атома галогену: Р 8'+ 8+ 8- К—СН-»^СН2-^На1 еГ Тому в більшості випадків разом з реакцією нуклеофільного заміщення атома галогену паралельно проходить реакція відщеплення галогеноводню з утворенням алкену. Реакції відщеплення, в яких аніон галогену Наї і протон Н+ відщеплюються від сусідніх атомів Карбону з утворенням п-зв'язку між ними, називають Р -елімінуванням. нуклеофільне заміщення сн3 сн2 он СН,—СН,—І + КаОН. . 2 р-ешмшування -МаІ;-НОН 2 ^ 2 етен Реакції нуклеофільного заміщення та елімінування конкурують одна з одною і за певних умов кожна з них може стати домінуючою. Відщеплення галогеноводню від галогеналкану стає переважним процесом у присутності нуклеофільних Глава 18 реагентів, які мають високу основність. До них належать спиртові розчини гідроксидів лужних металів (спиртовий розчин NaOH, KOH) або алкоголяти лужних металів (C2H5ONa, С2Н5ОК і т. ін.). елімінуванню сприяють також підвищення температури реакційної суміші і концентрації реагентів. Сприятливо впливає збільшення кількості замісників біля електрофільного атома Карбону. Тому найлегше елімінування відбувається в ряду третинних галогеналканів. Якщо в молекулі галогеналкану є кілька альтернативних шляхів відщеплення га-логеноводню, то реалізується з них переважно той, на якому подвійний зв 'язок утворюється при найбільш заміщеному атомі Карбону, тобто разом з галогеном відходить Гідроген від найменш гідрогенізованого сусіднього атома Карбону. ця закономірність отримала назву «правило Зайцева»:
сн3
СН3—С=СН—СН3 2-метил-2-буген ШОН (С2Н5ОН) сн3—сн—сн—сн3
Вг З-метил-1-бутен Аналогічно нуклеофільному заміщенню елімінування галогеналканів може проходити за бімолекулярним (E2) і мономолекулярним (E1) механізмами. механізм E2 (бімолекулярне елімінування).Механізм бімолекулярного елімінування E2 подібний до механізму бімолекулярного нуклеофільного заміщення SN2. Механізм E2 зображується такою схемою: Ч«+ ІР І«
В + Н —С —С—Наї;«=► галогеналкан перехідний стан в—н + \ / + Наї як бачимо, реакція за механізмом E2 аналогічно механізму SN2 проходить в одну стадію з утворенням перехідного стану, у формуванні якого беруть участь молекули двох реагентів. Тому швидкість такої реакції залежить від концентрації обох реагентів і описується кінетичним рівнянням другого порядку. Процеси розриву й утворення зв'язків у перехідному стані відбуваються синхронно. Різниця між механізмами SN2 і E2 полягає в тому, що в механізмі 8^ частинка з неподіленою парою електронів або яка несе негативний заряд, атакує електро-фільний атом Карбону молекули галогеналкану, діючи при цьому як нуклеофіл, а в механізмі E2 вона атакує атом Гідрогену при В-атомі Карбону, діючи як основа. Тому процеси SN2 і E2 є конкурентними. Найлегше за механізмом E2 відбувається елімінування в ряду первинних галогеналканів. механізм E1 (мономолекулярне елімінування).як механізм E2 подібний до механізму SN2, так і механізм E1 має велику схожість з SN1 і конкурує з ним. Реакція, яка проходить за механізмом E1, складається з двох стадій. На стадії I, як і в реакціях за механізмом SN1, під дією розчинника відбувається іонізація мо- ГаЛОГенОПОхІДнІ ВУГЛеВОДнІВ
Стадія І —С —С—Наї галогеналкан карбокатіон Стадія II _______ £_>.с+швидко С=С+ Н+ Н карбокатіон алкен Акцептором протона часто служить сам розчинник, наприклад вода, тому реакція, яка перебігає за механізмом E1, звичайно не вимагає присутності основи як реагенту. У реакції елімінування за механізмом E1 найлегше вступають третинні гал огеналкани. ВЗАЄМОДІЯ З МЕТАЛАМИ Гал огеналкани реагують з деякими металами (найчастіше — з магнієм), утворюючи метал органічні сполуки. При взаємодії галогеналканів з металічним магнієм у середовищі безводного діетилового етеру утворюються магнійорганічні сполуки, відомі як реактиви Гриньяра. с2н5сі + м§ -^>- с2н5м8сі етилмагнійхлорид Реактиви Гриньяра — надто реакційноздатні речовини. їх активність зумовлена полярністю зв'язку C—Mg. Оскільки атом Карбону має більшу електронегатив-ність, ніж Магній, зв'язок поляризований таким чином, що на атомі Карбону 5- d + локалізується частковий негативний заряд СH3—CH2MgCl. Магнійорганічні сполуки є сильними нуклеофільними реагентами і сильними основами. При взаємодії галогеналканів з металічним натрієм металорганічні сполуки утворюються як проміжний продукт (див. реакцію Вюрца, с. 131). ВІДНОВЛЕННЯ ГАЛОГЕНАЛКАНІВ При відновленні галогеналканів утворюються алкани. як відновник використовують водень у присутності каталізаторів гідрування або йодоводень:
С2Н5С1 С2Н5С1 ДИГАЛОГЕНАЛКАНИ Дигалогеналкани містять у своєму складі два атоми галогену. Атоми галогенів можуть знаходитися біля одного і того ж атома Карбону (гемінальні дигалогеналкани) , біля сусідніх атомів Карбону (віцинальні дигалогеналкани) або розділені кількома вуглець-вуглецевими зв'язками. Глава 18 256 Г СПОСОБИ ДОБУВАННЯ Приєднання галогеноводнів до алкінів(див. с. 169) призводить до утворення гемінальних дигалогеналканів: /СІ нс=сн -^>- н,с=сн—сі -^-*- сн,—сн \ СІ етин хлоретен 1,1-дихлоретан Взаємодія альдегідів і кетонів з пентагалогенідами фосфору(PCl5, PBr5). У процесі реакції утворюються гемінальні дигалогеналкани: /> , /С1 сн3—с^ + рсі5 -*-»► сн3—сн + росі3 ацеталвдегід 1,1-дихлоретан Вг сн3—с—сн3 + рвг5 -^ сн3—с—сн3 + ровг3 О Вг ацетон 2,2-дибромопропан Приєднання галогенів до алкенів(див. с. 146) веде до утворення віцинальних дигал огеналканів. сн3— сн=сн2 + вг2 -*-► сн3— сн—сн2 Вг Вг 1,2-дибромопропан ХІМІЧНІ ВЛАСТИВОСТІ Хімічні властивості дигалогеналканів аналогічні властивостям моногалогенал-канів: вступають у реакції нуклеофільного заміщення і відщеплення. Так, при лужному гідролізі дигалогеналканів, в яких атоми галогену перебувають при різних атомах Карбону, утворюються двохатомні спирти — гліколі: ГН-ГН 2ШОН; (Н2О) 3 СН СН2і^ЕІ СН3—СН—СН2 СІ СІ ОН ОН 1,2-дихпоропропан пропшенгліколь У присутності спиртових розчинів лугів при нагріванні гемінальні і віцинальні дигалогеналкани піддаються елімінуванню з утворенням алкінів: СІ < 2КаОН; (С2Н,ОН) „_„
* НС=СН ГН ГН СК 2КаОН; (С2Н5ОН) СН3—СН—СН2 -2КаС1;-2Н2О 3 СІ СІ 1,2-дихпоропропан пропін
Поиск по сайту: |
 Вторинні і третинні галогеналкани з аргентум нітритом AgNO2 в умовах реакції SN1 утворюють з високим виходом естерів нітритної кислоти:
Вторинні і третинні галогеналкани з аргентум нітритом AgNO2 в умовах реакції SN1 утворюють з високим виходом естерів нітритної кислоти: лекули галогеналкану з утворенням карбокатіона. Процес іонізації йде повільно і визначає швидкість реакції в цілому. На стадії II карбокатіон стабілізується, відщеплюючи протон від |3-атома Карбону, і утворює алкен:
лекули галогеналкану з утворенням карбокатіона. Процес іонізації йде повільно і визначає швидкість реакції в цілому. На стадії II карбокатіон стабілізується, відщеплюючи протон від |3-атома Карбону, і утворює алкен: