 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ІДЕНТИФІКАЦІЯ МОНОЯДЕРНИХ АРЕНІВ
Для ідентифікації моноядерних аренів найчастіше використовують спектральні методи — УФ-, ІЧ-, ПМР-спектроскопії та мас-спектрометрію. АрОматиЧнІ ВУГЛеВОДнІ. ОДНОЯДЕРШ АРЕНИ
Бензену і його гомологам притаманне характерне поглинання в УФ-ділянці: інтенсивне поглинання в діапазоні 180—210 нм і малоінтенсивне — в діапазоні 230—270 нм. При високій розділювальній здатності приладу малоінтенсивна смуга виявляється у вигляді ряду вузьких піків (тонка структура). Малоінтенсивне поглинання в ділянці 230—270 нм із тонкою структурою дуже характерне для ароматичних вуглеводнів, тому часто його називають смугою бензенового поглинання (рис. 14.3).
У ІЧ-спектрах бензену та його гомологів є характерні смуги поглинання в ділянці 3100— 3000 см~:, що пов'язані з валентними коливаннями ароматичних зв'язків С—Н і смуги в ділянці 1600—1500 см~:, зумовлені валентними коливаннями зв'язків СС бензенового ядра. Наявність зазначених смуг свідчить про присутність у структурі сполуки бензенового кільця. За характером інших смуг поглинання, особливо в ділянках 2000—1650 і 1225—950 см~:, можна установити кількість і взаємне розташування замісників у бензеновому ядрі. Сигнали ароматичних протонів у спектрі ПМР бензену і його гомологів виявляються в слабкому полі (5 = 6,5...8,0 млн"1). це пов'язано з дезекрануванням протонів за рахунок кільцевого струму, який утворюється при дії зовнішнього магнітного поля. У мас-спектрах бензену і його гомологів спостерігається інтенсивний пік молекулярного іона. ОКРЕМІ ПРЕДСТАВНИКИ. ВИКОРИСТАННЯ Бензен.Безбарвна рідина з характерним запахом (т. кип. 80,1 °С), нерозчинний у воді, горить дуже коптявим полум'ям. Бензен сильно отруйний. У хімічній промисловості широко використовується як розчинник і вихідна сировина для виробництва стирену, фенолу, циклогексану, аніліну, барвників, лікарських пре-паратів. толуен(метилбензен). Безбарвна рідина з характерним запахом (т. кип. 110,6°С). Толуен практично нерозчинний у воді, змішується з етиловим спиртом і діетиловим етером. Використовується у виробництві лаків, друкарських фарб, бензойної кислоти, вибухових речовин, лікарських препаратів тощо, а також як добавка до моторного пального для підвищення октанового числа бензинів. Має слабку наркотичну дію. Ксилени(о-, м- і п-диметилбензени). Безбарвні рідини з запахом бензену. Змішуються з етанолом, діетиловим етером, ацетоном, хлороформом, бензеном. Суміш ізомерних ксиленів, так званий технічний ксилен (т. кип. 138—144°С), використовується в промисловості як розчинник і високооктанова добавка до моторного пального. Глава 14 Стирен(вінілбензен). Безбарвна рідина зі своєрідним запахом (т. кип. 145,2°С). Використовується у виробництві полістиролу, синтетичного каучуку. Кумен(ізопропілбензен). Безбарвна рідина (т. кип. 152,4°С). Нерозчинний у воді, змішується з етанолом, діетиловим етером, бензеном. Використовується у виробництві фенолу й ацетону. n-Цимен(1-ізопропіл-4-метилбензен). Безбарвна рідина з приємним запахом (т. кип. 177,4°С). Нерозчинний у воді, розчиняється в етанолі, хлороформі, ацетоні, діетиловому етері. Входить до складу жирних олій багатьох рослин.
У жовтні 1996 року Харольд В. Крото (Великобританія), Річард Смоллі і Роберт Керл (СшА) були удостоєні Нобелівської премії за відкриття нової модифікації Карбону — С60. Сполуку С60 було названо «бакмінстерфулерен» або «бакі-бол» на честь відомого архітектора Бакмінстера Фуллера. Він розробив незвичайні сферичні будівлі, основним фрагментом яких є повторювані гексагональні фрагменти. Для того щоб геометричне тіло набуло сферичної поверхні, необхідно в певні положення ввести п'ятикутні фрагменти. Структура С60 нагадує футбольний м'яч, зшитий із 20 шести- і 12 п'ятикутних фрагментів.
У молекулі фулерену 5р -гібридизовані карбонові атоми утворюють о-зв'язки з трьома сусідніми атомами Карбону. У результаті перекривання негібридизованих 2p -орбіталей формується делокалізована МО. Кожен атом Карбону надає в систему делокалізованих МО по одному електрону. Таким чином, 20 шестикутних циклів у складі С60 є бензеновими кільцями. Наявність таких кілець — аргумент, що пояснює стійкість нової модифікації Карбону. Виникло уявлення про групу сполук за назвою «фулерени» як про нову групу ароматичних сполук. Вони більш реакційноздатні порівняно з аренами. Вступають у реакції нуклеофільного приєднання, що не характерно для аренів. Фулерени С60 мають високу електронну спорідненість і легко акцептують електрони з лужних металів. Отримано сіль С60К, що має надпровідні властивості. Дослідження у сфері фулеренів тривають. Глава 15
Багатоядерні арени з конденсованими циклами містять у своєму складі два або більше бензенових ядра, що мають спільні атоми Карбону. Залежно від способу зчленування циклів розрізняють два основних типи конденсованих систем: > конденсовані системи з лінійним розміщенням циклів:
нафтален антрацен тетрацен > конденсовані системи з ангулярним (від англ. ащеі — кут) розміщенням циклів:
фенантрен хризен Найважливішими представниками конденсованих аренів є нафтален, антрацен і фенантрен. НАФТАЛЕН Уперше нафтален було виділено з кам'яновугільної смоли 1819 року. елементний склад його молекули встановив російський хімік Олександр Абрамович Во-скресенський 1838 року, а будову довів німецький хімік Карл Гребе 1898 року. 15.1.1. НОМЕНКЛАТУРА. ІЗОМЕРІЯ Молекула нафталену складається з двох конденсованих бензенових кілець. Нумерацію атомів Карбону нафталенового ядра здійснюють відповідно до правил IUPAC. У молекулі нафталену, на відміну від бензену, атоми Карбону р[7 8 || х 2ІР не рівнозначні. Атоми Карбону в положеннях 1, 4, 5, 8 прийнято ^^^і^р позначати символом а і називати а-положення, а в положеннях 2, 3, 6, 7 — символом |3 і називати відповідно $-положення. Унаслідок нерівнозначності положень однозаміщені нафталени існують у вигляді а- і |3-ізомерів:
Сн, Глава 15
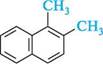
а -метилнафтален; 1 -метилнафтален р -метилнафтален; 2-метилнафтален У номенклатурі дизаміщених нафталену поряд з цифровими локантами по Двозаміщені нафталени з однаковими замісниками можуть існувати у вигляді десяти ізомерів положення:
1,2-диметилнафтален; о-диметилнафтален Сн,
1,3-диметилнафтален; лі-диметилнафтален
Сн, 1,4 -диметилнафтален; и-диметилнафтален
1,5-диметилнафтален; ана-диметилнафтален сн3 сн3
1,6-диметилнафтален 1,7-диметилнафтален
1,8 -диметилнафтален; ле/н-диметилнафтален 2,3 -диметилнафтален 2,6-диметилнафтален; омф('-диметилнафтален
2,7-диметилнафтален СПОСОБИ ДОБУВАННЯ Нафтален, його монометильні та деякі диметильні похідні в промисловості добувають переважно з кам 'яновугільної смоли (вміст нафталену в кам'яновугільній смолі становить близько 10%). Крім того, відомий ряд синтетичних методів добування нафталену та його гомологів. Так, нафтален поряд з бензеном утворюється при пропусканні ацетилену через нагріті до 700—800 °С трубки: БаГатОяДернІ арени З КОнДенСОВаними БенЗенОВими ЦиКЛами
5НС=СН + Нафтален і його гомологи одержують шляхом дегідроциклізації алкілбензенівз боковим ланцюгом з чотирьох і більше атомів Карбону: СН5
+ ЗН-, Пентилбензен А -метилнафтален Однак у зв'язку з високим вмістом нафталену і його гомологів у кам'яновугільній смолі синтетичні методи добування не мають практичного значення. БУДОВА НАФТАЛЕНУ електронна будова нафталену схожа з будовою бензену. Аналогічно бензену молекула нафталену планарна (плоска). Усі атоми Карбону перебувають у sp2 -гібридизації. Кожний з десяти атомів Карбону надає р-атомну орбіталь для утворення замкненої кон'югованої системи, яка охоплює всі атоми Карбону (рис. 15.1).
Рис. 15.1. Схема утворення замкненої % -електронної системи в молекулі нафталену Загальна кількість я-електронш у кон'югованій системі відповідає правилу ароматичності Гюккеля (див. c. 193). Проте ступінь ароматичності нафталену нижчий, ніж бензену. Методом рентгеноструктурного аналізу встановлено, що в нафталені порушена характерна для бензену вирівняність вуглець-вуглецевих зв'язків: зв'язки Са—С укорочені, а зв'язки С—С видовжені порівняно з вуглець-вуглецевими зв'язками бензену. Так, у молекулі нафталену довжина зв'язку Са—С становить 0,136 нм, зв'язку С—С — 0,142 нм, тоді як у бензені всі вуглець-вуглецеві зв'язки мають довжину 0,139 нм. як бачимо, у молекулі нафталену хімічні зв'язки між а- і |3-атомами Карбону більше нагадують подвійні (довжина зв'язку С—С в алкенах 0,134 нм). Унаслідок різної довжини вуглець-вуглецевих зв'язків у молекулі нафталену я-електронна густина розподілена нерівномірно. електронна густина у а-атомш Карбону вища, ніж у Р-атомш. Відповідно і енергія резонансу нафталену (255,2 кДж/моль) значно менша подвоєної енергії резонансу бензену (2 • 150,7 = 301,4 кДж/моль). Тому нафтален легше за бензен вступає в реакції заміщення, приєднання, окиснення і відновлення. Глава 15 Для зображення молекули нафталену в хімічній літературі використовують структурні формули I—III.
II. Застосування формули III малообґрунтоване, тому що нафтален не містить у своїй структурі двох незалежних замкнених кон'югованих систем бензену. 15.1.4. ХІМІЧНІ ВЛАСТИВОСТІ Для нафталену, як і бензену, властиві реакції електрофільного заміщення, приєднання, відновлення та окиснення. РЕАКЦІЇ ЕЛЕКТРОФІЛЬНОГО ЗАМІЩЕННЯ (SE) У реакції електрофільного заміщення нафтален вступає легше, ніж бензен. При взаємодії з електрофільними реагентами утворюються переважно продукти ^.-заміщення. Переважний напрям заміщення в а-положення зумовлений тим, що, по-перше, в а-положенні нафталену електронна густина вища, ніж у |3-положенні (статичний фактор), а по-друге, при атаці електрофілу в а-положення утворюється стабільніший, а тому енергетично більш вигідний для молекули с-комплекс, ніж при атаці в Р-положення (динамічний фактор):
Н З наведеної схеми видно, що при електрофільному заміщенні в а-положенні утворюється с-комплекс, в якому позитивний заряд може бути делокалізований без порушення ароматичної системи сусіднього кільця, тоді як у с-комплексі, що утворюється при заміщенні в |3-положенні, делокалізація позитивного заряду можлива тільки за рахунок порушення ароматичної системи сусіднього кільця, що спричиняє додаткову витрату енергії. нітрування. Нафтален досить легко нітрується нітруючою сумішшю з утворенням а-нітронафталену:
Н28О4 (конц.); 60 °С N0-, Н2О а -нітронафтален За більш жорстких умов здійснюється подальше нітрування, яке приводить до утворення суміші 1,5- і 1,8-динітронафталенів.
Поиск по сайту: |
 Фулерени
Фулерени


 Молекула фулерену С60
Молекула фулерену С60 БАГАТОЯДЕРНІ АРЕНИ З КОНДЕНСОВАНИМИ (АНЕЛЬОВАНИМИ) БЕНЗЕНОВИМИ ЦИКЛАМИ
БАГАТОЯДЕРНІ АРЕНИ З КОНДЕНСОВАНИМИ (АНЕЛЬОВАНИМИ) БЕНЗЕНОВИМИ ЦИКЛАМИ
















 сн,
сн,





 + Е+
+ Е+
 (конц.)
(конц.)