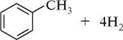|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Михайло Іванович КОНОВАЛОВ (1858-1906)
Російський хімік-органік. Учень В. В. Марковникова. Закінчив Московський університет (1884). Професор Київського політехнічного університету з 1899 року, потім ректор (1902-1904). Основні наукові праці присвячені вивченню дії нітратної кислоти на органічні сполуки. Вивчив нітруючу дію розведеної нітратної кислоти на аліфатичні (реакція Коновалова), алі-циклічні і жирноароматичні вуглеводні. Своєю реакцією він, за словами М. Д. Зелінського, «оживив хімічних мерців», якими в той час вважали парафінові вуглеводні. Розробив методи одержання оксимів, альдегідів, кетонів та спиртів на основі нітросполук жирного ряду. К—Н + 8О2+ С12 -^ К—8О2С1 + НС1 алкан алканоульфоніл- хлорид
як і у випадку галогенування, реакція сульфохлорування алканів проходить за ланцюговим радикальним механізмом (SR): СГ + Сl
к- + неї К—8О2- R—8О9С1 + СГ і т. д. R— У результаті реакції утворюється суміш первинних і вторинних алкансульфонілхло-ридів. Третинні сульфонілхлориди не утворюються, мабуть, унаслідок просторових перешкод. Реакція сульфохлорування має важливе значення у виробництві синтетичних мийних засобів. нітрування.Рідкофазове нітрування алканів, назване реакцією Коновалова (1888), здійснюється з використанням розведеної нітратної кислоти (концентрація 10—20%-ва) при температурі 110—140°С, нормальному або підвищеному тиску:
К—Н + НNО3 (розв.) t,p R— нітроалкан Реакція перебігає за вільнорадикальним механізмом:
НО— К—H + НО-Г + HO—N0 НО- + 1ЧО2' к- + н2о R—N02 + но' Нітрування алканів характеризується високою регіоселективністю: СН3—С—СН2—СН3 + НЖ>3(розв.) н ізопентан CH3—с—сн2—сн3 N02 2 -метил-2 -нітробутан Н20 Концентрована нітратна кислота в звичайних умовах не взаємодіє з алканами; при нагріванні вона діє головним чином як окисник. АЛІФатиЧнІ ВУГЛеВОДнІ. аЛКани
У надлишку кисню або на повітрі алкани згорають з утворенням карбон(IV) оксиду і води з виділенням великої кількості теплоти: СН4 + 2О2 —► СO2 + 2Н2O + 882 кДж/моль Окиснення алканів киснем повітря в присутності каталізатора (солей Мангану, Хрому, Плюмбуму тощо) при температурі 150—200°С приводить до утворення суміші продуктів, яка складається в основному з карбонових кислот з різною довжиною вуглецевого ланцюга, альдегідів, кетонів і спиртів. Реакція перебігає за радикальним механізмом і супроводжується розривом вуглець-вуглецевих зв'язків. як проміжні продукти окиснення утворюються органічні гідропероксиди. Схема окиснення пропану: СН3-СН2-СН3 -^ СН3-СН-СН3 ■%■ СН3-СН-СН3 О—о- сн3—сн—сн3 —► сн3—с/ + сн3—он + сн3—с—сн3 + н2о хн гідропероксид ацетальдегід метанол ацетон сн3—с/ н—с/ чон чон оцтова мурашина кислота кислота Реакція окиснення використовується в промисловості для одержання метанолу, формальдегіду, ацетальдегіду та оцтової кислоти з пропану і бутану, а також вищих жирних кислот з алканів з довжиною ланцюга більше 25 атомів Карбону. КРЕКІНГ АЛКАНІВ Крекінг — процес термічного розщеплення алканів. Під дією високих температур алкани розкладаються з розривом зв'язків С—С і С—Н. Одночасно проходять процеси дегідрування, ізомеризації і циклізації. Початкова температура розпаду алканів залежить від їх будови і молекулярної маси: чим більша молекулярна маса вуглеводню, тим легше він розщеплюється при нагріванні. Розрізняють термічний крекінг і каталітичний крекінг. Термічний крекінг проводять при температурі 800°С і вище, каталітичний — при температурі 450—550°С в присутності алюмосилікатних каталізаторів (алюміній оксид Аl2О3 на силікагелі SiО2). Найстійкіший до термічного розкладу метан. В інтервалі температур 1400—1500 °С він піддається розпаду з утворенням ацетилену: 2СН4 етан розкладається при нижчих температурах: CH3— CH3 Глава 9 Вищі алкани в умовах термічного крекінгу розкладаються з утворенням складної суміші нижчих алканів і алкенів. Розрив вуглецевого ланцюга молекули може відбутися в будь-якому положенні:
■сн4 + н2с=сн—сн2—сн2—сн3 ■сн3—сн2—сн3 + н2с=сн—сн3 сн3—сн2—сн2—сн3 + н2с=сн2 Термічний крекінг проходить за радикальним механізмом. При каталітичному крекінгу розщеплення вуглець-вуглецевого зв'язку супроводжується переважно ізомеризацією н-алканів в алкани з розгалуженим ланцюгом: А1,О,; 500°C 2СН3—СН2—СН2—СН2—СН2—СН3 ——-------------------- ► гексан і 3 —>■ 3—сн—сн—сн3 + CH3—с—сн2—сн3 С-гі3 С-гі3 2,3-диметилбутан 2,2-диметилбутан У присутності каталізатора вищі алкани здатні до циклізації з утворенням ароматичних вуглеводнів:
Сг,О,; А1,О,; 500°C сн3—сн2—сн2—сн2—сн2—сн2—сн3 -2-5—2-5------- ► гептан толуен Каталітичний крекінг відбувається за іонним механізмом. Крекінг-процес має важливе промислове значення і широко використовується для одержання високооктанових бензинів, ненасичених і ароматичних вуглеводнів. ІДЕНТИФІКАЦІЯ АЛКАНІВ Хімічні методи для ідентифікації алканів не застосовують. Алкани ідентифікують за фізичними константами (температурами кипіння і плавлення, показником заломлення, питомим обертанням для оптично активних речовин тощо) і спектральними характеристиками. Алкани поглинають УФ-випромінювання в ділянці менше 200 нм, тому рідкі алкани використовують як розчинники для вимірювання електронних спектрів інших речовин. Для ІЧ-спектрів алканів характерні смуги поглинання в ділянці 3000—2850 см~:, які відповідають валентним коливанням зв'язків С—Н, і в ділянці 1470—1370 см~:, що характеризують деформаційні коливання зв'язків С—Н. У ПМР-спектрах алканів різні за розташуванням протони мають близькі значення хімічних зсувів (0,5—2 млн"1), що ускладнює інтерпретацію ПМР-спектрів.
Поиск по сайту: |
 9.6.2. ОКИСНЕННЯ АЛКАНІВ
9.6.2. ОКИСНЕННЯ АЛКАНІВ