|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
СПІЛЬНЕ ВИЯВЛЕННЯ ІНДУКТИВНОГО І МЕЗОМЕРНОГО ЕФЕКТІВ ЗАМІСНИКІВ
Раніше відзначалося, що індуктивний ефект виявляється в органічних сполуках завжди за наявності в молекулі атомів з різною електронегативністю. Мезомерний Глава 4 56 Г же ефект виявляється лише в тому разі, якщо замісник входить у кон'юговану систему. Тому включені в кон'юговану систему замісники викликають поляризацію зв'язків за рахунок індуктивного і мезомерного ефектів. ці ефекти можуть співпадати і не співпадати за напрямом: |н2ср»-с=9:н2 ^2... 1 +М " -I, +M акрилонітрил алільний карбаніон фенол Здебільшого індуктивний і мезомерний ефекти замісників співпадають за напрямом. У замісників, які містять атоми з неподіленими електронними парами, індуктивний та мезомерний ефекти мають протилежні напрями і ніби «гасять» один одного. Оскільки електрони я-зв'язку поляризуються легше порівняно з електронами о-зв'язку, більш виразний вплив на поляризацію молекул справляє мезомерний ефект, тобто мезомерний ефект замісника, як правило, більший за його індуктивний ефект. Виняток складають лише атоми галогенш (Р, Сl, Br, I), для яких у статичному (нереагуючому) стані молекули +М-ефект менший за —І-ефект, але в процесі реакції (динамічний стан) і для них +М-ефект більший за —І-ефект. Замісники, які підвищують електронну густину в молекулі, називають електро-нодонорними, а замісники, що знижують її, — електроноакцепторними. Унаслідок спільного виявлення індуктивного і мезомерного ефектів замісника відбувається альтернування (чергування) поляризації в кон'югованій системі за значенням зарядів: 4 3 2 1 1 -хлор -1,3 -бутадієн Так, у молекулі 1-хлор-1,3-бутадієну в результаті —I-ефекту атома Хлору, який більший за +М- ефект, усі атоми Карбону набувають часткового позитивного заряду. Але завдяки +М-ефекту Хлору на атомах C-2 і C-4 електронна густина дещо збільшується. І незважаючи на те що в результаті всі атоми Карбону несуть частковий позитивний заряд, у положеннях C-2 і C-4 він менший, ніж у C-1 і C-3, тобто відбувається чергування поляризації за значенням заряду1 . Аналогічне явище спостерігається в системах із замкненим ланцюгом кон'югації. ^ > о- анілін У молекулі аніліну -І-ефект аміногрупи викликає зниження електронної густини на всіх атомах Карбону бензенового кільця. Однак, оскільки +М- ефект аміногрупи за рахунок неподіленої пари електронів атома Нітрогену більший за -І-ефект, це веде в цілому до підвищення електронної густини на атомах Кар-
ВЗаЄмниЙ ВПЛиВ атОмІВ В ОрГанІЧних СПОЛУКах бону кільця й особливо в положеннях 2, 4 і 6, тобто відбувається альтернувальна поляризація. Звичайно в молекулах з відкритим ланцюгом кон'югації вказують часткові заряди, зосереджені на кінцевих атомах кон'югованої системи, а в замкнених кон'югованих системах — максимальні заряди на атомах:
Н0С—С Сч ( \н н акролеїн
фенол ГІПЕРКОН'ЮГаЦіЯ У молекулах деяких органічних сполук має місце гіперкон 'югація (надспря-ження). Гіперкон'югація — взаємодія, що виникає в молекулі, карбокатіоні або у вільному радикалі в результаті перекривання о-орбіталі С—н-зв'язків із сусідніми п- або p-орбіталями і приводить до додаткової стабілізації системи (о,п- або о,р-кон 'югація). Гіперкон'югація характерна для сполук, у молекулах яких sp3 -гібридизований атом Карбону, що має принаймні один атом Гідрогену, розташований поряд із кратним зв'язком, ароматичною системою (о,п-кон 'югація) або фрагментом молекули з вакантною або частково заповненоюр-орбіталлю (с,р-кон'югація).
ефект гіперкон'югації позначають символом Mh (індекс h від англ. «hyperconjugation» — гіперкон'югація) і схематично зображують за допомогою вигнутої стрілки .
н о, 7Г-Кон'югація н=снп н н-ьс
н пропен н К н етил-катіон н ацетонітрил н н н-ьс^-сн-^сч-н Ч V н н ізопр опіл -катіон н толуен н К н етил-радикал З позицій квантово-механічної теорії гіперкон'югацію розглядають як часткове перекривання с-орбіталей С—Н-зв'язків з я-орбіталлю сусіднього кратного зв'язку, ароматичної системи абор-орбіталлю проміжно активних частинок (кар-бокатіонів, вільних радикалів) (рис. 4.2). ефективність перекривання о-орбіталі С—Н-зв'язків з я- або р-орбіталлю невисока, тому що вони не паралельні. ефект гіперкон'югації залежить від кількості атомів Гідрогену при а-атомі СН,-
Карбону і зменшується в ряду: І Глава 4
н етил-радикал Рис. 4.2. Схема перекривання а-орбіталей зв'язків С—Н з л-орбіталлю кратного зв'язку в молекулі пропену, р-орбіталлю в етил-катіоні і етил-радикалі Унаслідок гіперкон'югації атоми Гідрогену при а-атомі Карбону активуються (протонуються) і виявляють підвищену реакційну здатність.
Поиск по сайту: |
 1 Знак 8 + + означає, що в цьому положенні електронна густина нижча, ніж у положенні зі знаком 5 + .
1 Знак 8 + + означає, що в цьому положенні електронна густина нижча, ніж у положенні зі знаком 5 + .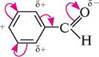
 о,^-Кон'югація
о,^-Кон'югація