 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Тесты для самоконтроля. 1. Выражение ω (СаС12)= 5% означает:
1. Выражение ω (СаС12)= 5% означает: а) 5 г СаС12 растворено в 95 г Н2О, б) 5 г СаС12 растворено в 100 г Н2О, в) 5 г СаС12 растворено в 1000 г Н2О. г) 5 г СаС12 растворено в 100 г раствора 2. Эквивалентная масса меди в соединении СuSO4 равна: а) 80,0 г/моль, б) 31,75 г/моль, в) 79,5 г/моль, г) 16 г/моль. 3. Укажите истинный раствор: а) мел + вода, б) вода + поваренная соль, в) вода + глина, г) вода + масло. 4. Молярная концентрация показывает: а) сколько г растворенного вещества содержится в 100 г воды; б) сколько молей растворенного вещества содержится в 1 л раствора; в) сколько моль-экв растворенного вещества содержится в 100 мл раствора; г) сколько мл растворенного вещества содержится в 1000 мл раствора. 5. Эквивалентую массу щавелевой кислоты, вступающей в реакцию c гидроксидом натрия, рассчитывают по следующей формуле: а) МЭкв=2М, б) МЭкв=М/2, в) МЭкв=М/4, г) МЭкв=М/n. 6. Нормальная концентрация – это количество моль вещества, растворенного в: а) 1 л раствора, б) 1 л растворителя, в) 100 г растворителя, г) 100 г раствора. 7. Титр показывает сколько: а) г вещества содержится в 1000 мл раствора, б) г вещества содержится в 1 мл раствора, в) г вещества содержится в 100 г раствора. г) г вещества содержится в 1000 мл воды 8. Приведите основную формулу для определения концентраций в объемном анализе. а) С1V2= С2 V1, б) С1V1= С2 V2, в) 9. Масса хлорида натрия количеством вещества 0,8 моль равна: а) 58,5 г, б) 46,8 г, в) 29,25 г. г) 56,25г. 10. Массовая доля показывает количество: а) моль-экв/л; б) г растворенного вещества на 100 г воды; в) 1 моль вещества в 1 л раствора; г) г растворенного вещества в 100 г раствора. 11. Эквивалент Cu(NO3)2 равен: а) 188 г/моль; б) 171 г/моль; в) 94 г/моль; г) 114 г/моль. 12. Массовая доля метилового спирта в растворе, содержащем 60 г спирта и 40 г воды равна: а) 2, б) 0,6, в) 1,5, г) 0,5. 13. При полной нейтрализации Н3РО4 её эквивалент равен: а) 49 г/моль, б) 98 г/моль, в) 32,6 г/моль, г) 196 г/моль. 14. Методом точной навески можно приготовить раствор: а) Na2CO3, б) HCl, в) H2SO4, г) KOH. 15. Выражение 0,1N р-р КMnO4 означает: а) 0,1 моль-эквивалента КМnО4 растворено в 1 л раствора, б) 0,1 моль КМnО4 растворено в 1 л раствора, в) 0,1 моль-экв. растворено в 1 л растворителя, г) 0,1 моль КМnО4 растворено в 1000 мл воды. 16. Стандартный раствор – это раствор: а) концентрация которого неизвестна, б) концентрация которого известна, в) раствор, который получился при титровании 2-х других растворов, г) раствор при титровании которого выпадает осадок. 17. При острых кишечных инфекциях в кровь вводят 0,89% раствор хлорида натрия. Масса соли, введенная в организм при вливании 400 мл этого раствора равна (ρ = 1 г/мл): а) 35,6 г б) 0,356 г в) 3,56 г г) 3,6 г 18. При растворении 30 г гидроксида натрия в 100 г Н2О массовая доля его будет равна: а) 0,23, б) 0,4, в) 0,17, г) 0,01. 19. Адреналин обладает сосудосуживающим действием. Его терапевтическая доза составляет 0,5 мл 0,1% раствора, ρ = 1,0 г/мл, масса адреналина, содержащаяся в этом растворе равна: а) 0,5 г б) 0,0005 г в) 0,005 г г) 0,1 г 20. При коньюктивитах в виде глазных капель применяют раствор сульфата цинка. Массы сульфата цинка и воды необходимые для приготовления 25 мл 0,25% раствора (ρ = 1,02 г/мл) равны: а) 6,372 и 19,128 б) 6,0 19 в) 6,25 и 18,75 г) 7 и 18
Литература ЛИТЕРАТУРА ОСНОВНАЯ 1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учебник для медицинских вузов. /Ю.А. Ершов, В.А. Попков, А.С. Берлянд и другие. Под ред. Ю.А. Ершова, 8 изд.,560 с. – М.: Высш. Шк., 2010. 2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учебное пособие для студентов медицинских вузов. (Ред. В.А. Попков).- М., Высшая Ответы к тестам школа, 4 изд., 239 с., 2008 г. 3. Сборник задач и упражнений по общей химии. Учебное пособие. (С.А.Пузаков, В.А. Попков, А.А. Филиппова). М: Высшая школа, 4 изд., 255с., 2010г.
Поиск по сайту: |
 V2=
V2= 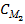 V1
V1