 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Степень электролитической диссоциации
Если бы электролиты полностью диссоциировали на ионы, то понижение температуры замерзания и другие свойства электролитов всегда были бы в целое число раз больше теоретических значений, рассчитанных по соответствующим формулам. Но еще Вант-Гофф установил, что коэффициент I выражается дробными числами, которые с разбавлением раствора возрастают, приближаясь к целым числам. Аррениус объяснил этот факт тем, что лишь часть электролита диссоциирует в растворе на ионы, и ввел понятие степени диссоциации. Степенью диссоциации электролита
Степень электролитической диссоциации принято выражать либо в долях единицы, либо в процентах. По своей природе электролиты можно разделить на три группы: сильные, средней силы и слабые электролиты. Отнесение электролита к той или иной группе основано на экспериментально определяемом по электропроводности его 0,1 н. раствора при 25 Сильные электролиты в водных растворах диссоциируют практически полностью. Для сильных электролитов Электролиты средней силы диссоциируют лишь частично. Для сильных электролитов Слабые электролиты диссоциируют на ионы в очень малой степени; в растворах они находятся преимущественно в виде молекул. Для слабых электролитов В таблице 2 приведены примеры электролитов различной силы. Табл. 2. Электролиты
Степень диссоциации 1) От природы реагирующих веществ. 2) От природы растворителя. Так, например, известно, что HCl хорошо диссоциирует в полярном растворителе − воде, в малополярном растворителе − этаноле C2H5OH – значительно хуже и совсем не диссоциирует в неполярном растворителе − бензоле C6H6. Таким образом, 3) От температуры. С ростом температуры 4) От концентрации растворенного вещества. С разбавлением раствора (то есть с уменьшением его концентрации)
Поиск по сайту: |
 называется отношение числа его молекул, распавшихся на ионы n, к общему числу его молекул, введенных в раствор N:
называется отношение числа его молекул, распавшихся на ионы n, к общему числу его молекул, введенных в раствор N:  ,
, значении степени электролитической диссоциации.
значении степени электролитической диссоциации. .
.

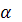 зависит:
зависит: