 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Состав ядра атома. Определение массы атомного ядра ⇐ ПредыдущаяСтр 2 из 2
После создания ядерной модели атома вопрос о составе атомного ядра стал одним из основных в ядерной физике. Из чего состоит атомное ядро? Какие силы удерживают составные части ядра друг возле друга? Какие превращения ядер возможны? Ответы на эти вопросы физика смогла дать только по мере накопления сведений о различных свойствах ядер, в особенности сведений о заряде и массе ядра. Заряд ядра qя = Ze (в СИ измеряется в кулонах). В единицах элементарного заряда заряд ядра равен Z. Массу ядра выражают обычно в атомных единицах массы. За атомную единицу массы (а.е.м) принята 1/12 массы атома углерода 1 а.е.м. = 1,6605402 • 10-27 кг. Так как масса электрона очень мала, то масса ядра атома приблизительно равна его атомной массе. Целое число, ближайшее к значению атомной массы, выраженной в а.е.м., называется массовым числом А. Условились ядро обозначать химическим символом атома, которому оно принадлежит, с двумя индексами; вверху — массовое число, внизу — заряд в единицах элементарного заряда, называемый иногда зарядовым числом: Например, ядро атома кислорода В 1919 г. Э. Резерфорд и П. М. С. Блеккет, осуществив первую ядерную реакцию, на опыте обнаружили протон:
714N + 24He → 817O + 11p
Если бы в состав ядер сходили только протоны, то заряд ядра, выраженный в элементарных зарядах, был бы численно равен массе ядра, выраженный в атомных единицах массы. Было обнаружено, что массы всех атомов, кроме водорода, выраженные в а.е.м., превышают численно заряды их ядер, выраженные в единицах элементарного заряда: В 1920 г. Резерфорд высказал предположение, что в ядрах атомов имеются какие-то электрически нейтральные частицы с массой, приблизительно равной массе протона. В 1932 г. сотрудник Резерфорда Дж. Чедвик обнаружил их на опыте, бомбардируя атомы бериллия
49Be + 24He → 612C + 01n Вскоре после открытия нейтрона в 1934 г. советский ученый Д. И. Иваненко и немецкий физик В. Гейзенберг независимо друг от друга предложили протонно-нейтронную модель ядра, согласно которой атомное ядро состоит из протонов и нейтронов (их общее название — нуклоны). Число протонов в ядре равно Z — зарядовому числу, которое равно порядковому номеру химического элемента в таблице Менделеева. Так как атом в целом нейтрален, то число Z определяет одновременно и число электронов в атоме, и их распределение по оболочкам, так как это распределение зависит от их общего числа. Массовое число А определяет общее число нуклонов. Следовательно, число нейтронов в ядре равно N=A-Z. Если проследить за распределением числа протонов Z и нейтронов N в ядрах различных элементов периодической таблицы Менделеева, то можно заметить, что для ядер элементов вплоть до середины таблицы число нейтронов примерно равно числу протонов, так что 5 Изотопы.Исследования показали, что в природе существуют атомы одного и того же элемента с разной массой. Так, встречаются атомы хлора с массой 35 и 37. Ядра этих атомов содержат одинаковое число протонов, но разное число нейтронов.
Поиск по сайту: |
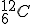 .
. .
.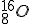 , углерода
, углерода 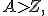 причем по мере увеличения Z это различие возрастает. Из этого следовало, что протоны не могут быть единственными частицами, составляющими ядро.
причем по мере увеличения Z это различие возрастает. Из этого следовало, что протоны не могут быть единственными частицами, составляющими ядро.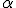 -частицами. Эту частицу назвали нейтроном
-частицами. Эту частицу назвали нейтроном 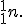 Нейтрон — элементарная частица, заряд которой равен 0, а масса близка к массе протона mp= 1,6749 • 10-27 кг = = 1,00866 а.е.м.
Нейтрон — элементарная частица, заряд которой равен 0, а масса близка к массе протона mp= 1,6749 • 10-27 кг = = 1,00866 а.е.м. 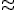 1 а.е.м.
1 а.е.м.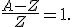 По мере утяжеления ядер количество нейтронов возрастает и в конце таблицы
По мере утяжеления ядер количество нейтронов возрастает и в конце таблицы 