 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Экспериментальная часть. Используемые приборы, оборудование и реактивы: высокоомный вольтметр ⇐ ПредыдущаяСтр 2 из 2
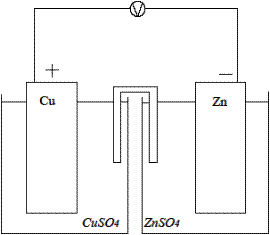
Используемые приборы, оборудование и реактивы: высокоомный вольтметр, набор металлических пластин (Cu, Pb, Zn и др.), растворы солей металлов (ZnSO4, CuSO4, Pb(NO3)2 и др.), стаканы, соединительные провода, электролитический ключ (солевой мостик). Выполнение работы: Опустить два металлических электрода в растворы соответствующих солей (концентрации указываются преподавателем). Глубина погружения 1-2 см. Подождать 5 минут (минимально) для установления равновесия. Собрать замкнутую цепь, включающую электроды и высокоомный вольтметр, который с большой точностью может быть использован вместо компенсационной схемы. Растворы соединить солевым мостиком (насыщенные растворы KNO3 или KCl в агар-агаре). Через 2-3 минуты измерить ЭДС (Eэксп). (Рис. 4)Результаты эксперимента занести в таблицу:
Рис.4
Методика решения типовых задач. 1) В каком направлении будут перемещаться электроны во внешней цепи гальванического элемента Mg|Mg2+||Pb2+|Pb, если растворы электролитов одномолярные? Какой металл будет растворяться? Определите ЭДС. Решение. Стандартный электродный потенциал магниевого электрода равен -2,36В и более отрицательный, чем стандартный электродный потенциал свинцового электрода (-0,13В). Следовательно, магний более активно окисляется Mg-2e-→Mg2+ .Избыточные электроны будут во внешней цепи переходить с магниевой пластины на свинцовую. Магниевый электрод будет служить анодом, а свинцовый- катодом. Схема гальванического элемента может быть записана как:
Стандартная ЭДС элемента: 2) Вычислите электродный потенциал цинка, опущенного в раствор его соли с концентрацией ионов цинка 0,001 моль/л. Решение. Вычисление электродного потенциала производят по уравнению Нернста: Стандартный электродный потенциал цинка равен -0,76В. Отсюда
3) Гальванический элемент состоит из серебряного электрода, погруженного в 1М раствор AgNO3 Решение. Поскольку концентрация Ag+ составляет 1 моль/л, то значение электродного потенциала серебряного электрода может быть взято из таблицы На водородном электроде будет происходить процесс окисления, т.е. этот электрод будет служить анодом: Суммарная реакция, происходящая при работе гальванического элемента: Схема рассматриваемого гальванического элемента имеет следующий вид: Электродвижущая сила:
4) Для взаимодействующих окислительно-восстановительных систем Решение. Система с меньшим потенциалом будет служить анодом (отрицательным электродом), характеризующимся процессом окисления А: К: ЭДС гальванического элемента:
5) Определить ЭДС гальванического элемента В каком направлении будут перемещаться электроны во внешней цепи при работе данного? Решение. Стандартный электродный потенциал системы
Вычисляем ЭДС элемента:
Поскольку
Контрольные вопросы и задачи. 1) Составить схемы двух гальванических элементов, в одном из которых железо служило бы катодом, а в другом- анодом. Написать уравнения реакций, происходящих при работе этих элементов, и вычислить значения стандартных ЭДС. 2) Какой электродный потенциал больше (в алгебраическом смысле): кальция в 5 моль/л растворе его соли или калия в 0,001 моль/л растворе его соли? 3) Вычислите потенциал водородного электрода, если концентрация ионов водорода [H+] в растворе равна 3,8 10-3 моль/л. 4) Цепи для определения электродных потенциалов металлов имеют вид: Для каждой из перечисленных цепей: а) указать, какую роль (окислителя или восстановителя) и в какой форме (H2 или H+) играет водород; б) обозначить знаки полюсов и направление перемещения электронов по внешнему металлическому проводнику; в) записать электронно-ионнными уравнениями, как сдвигается равновесие
5) Электродные потенциалы взаимодействующих систем
Приложение. Таблица «Стандартные окислительно-восстановительные потенциалы (по отношению к потенциалу стандартного водородного электрода)»
Библиографический список Коровин, Н.В. Общая химия. М. :Издательский центр «Академия»; 2013.496 c. Химия. Учебник для вузов /А.А.Гуров, Ф.З.Бадаев, Л.П.Овчаренко, В.Н.Шаповал. М.: Издательский центр МГТУ им. Н.Э.Баумана ,2004. 784 с. Гольбрайх ,З.Е., Маслов ,Е.И.Сборник задач и упражнений по химии .М.: Издательская группа АСТ,2007 .383 с. Краткий справочник физико-химических величин /под ред. А.А.Равделя и А.М.Пономаревой; М.: ТИД «Аз-book»,2009 .241с.
Поиск по сайту: |
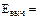

 (В)
(В)
 (В)
(В)
 (В)
(В)
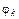 (В)
(В)




 и стандартного водородного электрода. Написать уравнение электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его ЭДС.
и стандартного водородного электрода. Написать уравнение электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его ЭДС. Так как
Так как  то на серебряном электроде будет происходить процесс восстановления, т.е. он будет служить катодом:
то на серебряном электроде будет происходить процесс восстановления, т.е. он будет служить катодом: 


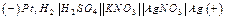
 Так как
Так как  то Е=0,80 В.
то Е=0,80 В. и
и  электродные потенциалы соответственно равны
электродные потенциалы соответственно равны  и
и  Составить схему гальванического элемента, напишите суммарную окислительно-восстановительную реакцию. Определите значение ЭДС гальванического элемента.
Составить схему гальванического элемента, напишите суммарную окислительно-восстановительную реакцию. Определите значение ЭДС гальванического элемента. Система с меньшим потенциалом будет служить катодом (положительным электродом), характеризующимся процессом восстановления
Система с меньшим потенциалом будет служить катодом (положительным электродом), характеризующимся процессом восстановления Для такого процесса реакция должна иметь вид
Для такого процесса реакция должна иметь вид  или
или 


 равен 0,80 В. Обозначив электродный потенциал левого электрода через
равен 0,80 В. Обозначив электродный потенциал левого электрода через  , а правого
, а правого  находим:
находим:


 то левый электрод служит отрицательным полюсом элемента и электроны будут перемещаться во внешней цепи от левого электрода к правому.
то левый электрод служит отрицательным полюсом элемента и электроны будут перемещаться во внешней цепи от левого электрода к правому.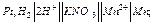
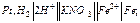


 в каждом отдельном случае.
в каждом отдельном случае. и
и  соответственно равны
соответственно равны 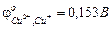 и
и 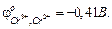 Составить схему работы гальванического элемента и определите ЭДС. Напишите суммарную реакцию.
Составить схему работы гальванического элемента и определите ЭДС. Напишите суммарную реакцию. Li
Li


