|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Сохранение и совершенствование генетической
Информации Как уже писалось в §5.6, основным носителем наследственной информации является молекула ДНК. По сути дела, все многообразные формы жизнедеятельности организма можно свести к одной единственной цели – сохранению структуры ДНК, т.е. её химической формулы. В §5.5 показано, как эта цель обеспечивается строением молекулы ДНК и её упаковки в клетке – хромосомы. Здесь же дадим сначала описание известных современной биологии методов восстановления (репарации) молекулы ДНК, используемых спонтанно соответствующими органеллами клетки [58], а затем методов её развития.
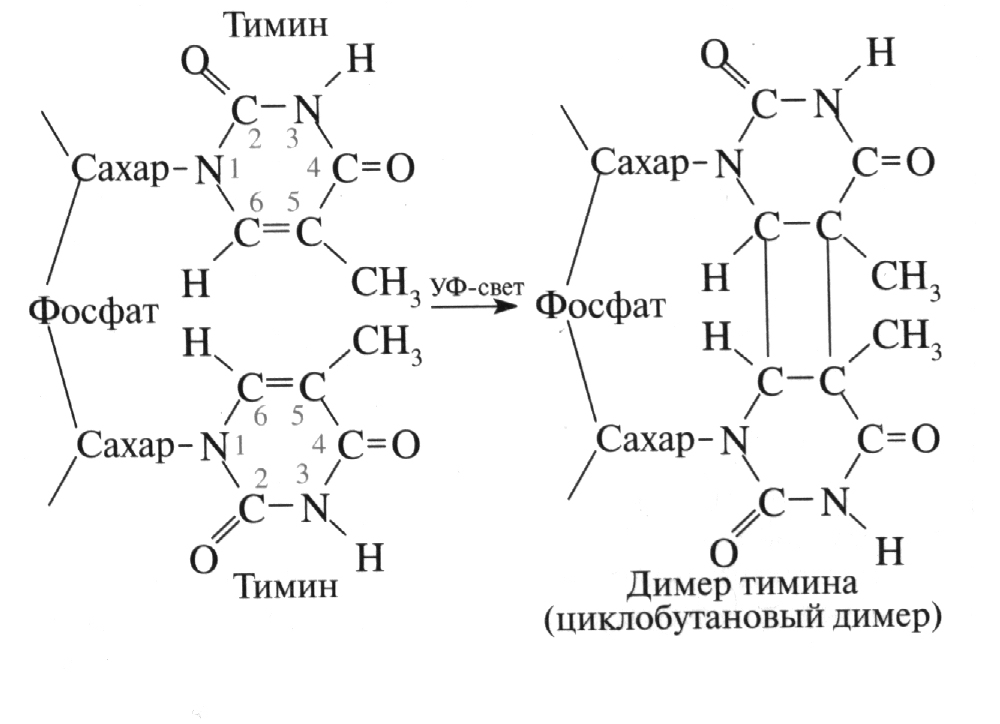
В клетке присутствует специальный белок – фермент фотолиаза, который при воздействии видимого спектра света (его синей части) восстанавливает исходные связи. 2. Репарация О6 – алкилированного гуанина. Имеется большая группа химических мутагенов, повреждающих нуклеотиды ДНК путём добавки к ним метильной группы СН3. При этом разрывается одна из связей углерода кольца сахарозы. У атома кислорода она защищается указанной группой, а у атома углерода создаёт дополнительную связь с соседним атомом азота. Указанный дефект устраняется белком метилтрансфераза, который отрывает от ДНК метильную группу. Оторванная группа оказывается соединённой с молекулой метилтрансферазы. Поэтому для нового повреждения нужна новая молекула – репаратор. Например, в клетке Е.coli синтезируется 100 молекул метилтрансферазы в минуту. Если число повреждений данного типа растёт с большей скоростью, клетка гибнет. 3.Репарация однонитевых разрывовДНК. Если под действием ионизирующего излучения происходит разрыв одной из двух нитей ДНК, то восстановление разорванного участка по записи комплементарной нити осуществляется ферментом ДНК – полинуклеотидлигазой. 4.Репарация АП-сайтов. В нуклеотидах пуриновой и пиримидиновой групп (см. §6.3) под воздействием внешних условий может разрываться ковалентная связь между основанием и сахарозой. Такой разрыв в ДНК именуется АП - сайтом (Апириновый и Апиримидиновый сайт - брешь). В клетках имеются ферменты – инсертазы (от англ. Insert - вставлять), которые заменяют повреждённое основание нуклеотида. 5.Эксцизионная репарация (от англ. Excision - вырезание). При более сложных повреждениях участков ДНК они сначала обнаруживаются ферментами – гликолазами (от слов «гликолизная связь» - ковалентная связь между основанием и сахарозой нуклеотида), которые разрывают указанную связь, превращая её в АП-сайт. Затем вступает в действие фермент – АП-эндонуклеаза, который отщепляет повреждённое основание. Следующий фермент – фосфодиэстераза отщепляет от ДНК остаток повреждённого нуклеотида – сахарофосфатную группу. Таким образом, действием двух ферментов оказывается полностью удалён соответствующий нуклеотид. Заделку образовавшейся бреши осуществляет фермент полинуклеотид-лигаза, о котором говорилось выше. В некоторых эукариотах вырезается не один нуклеотид, а целый участок вокруг места повреждения. Эту реакцию осуществляет мультиферментный комплекс, именуемый эксинуклеаза. 6.Репарация неспаренных оснований (мисмэтчей – от англ. mismatch). Суть этого дефекта заключается в том, что в процессе репликации молекул ДНК – расщеплении её на две дочерние (см.§6.4) – могут возникнуть некомплементарные пары нуклеотидов (например, вместо А-Т пара А-Ц или вместо Г-Ц пара Г-Т). О том, насколько часто возникают такие ошибки (мисмэтчи) можно судить по бактерии Е.coli: у неё на 105 пар нуклеотидов приходится одна дефектная (при общем числе 2´106 пар [39]). Исправление дефекта дочерней молекулы ДНК осуществляется ещё до окончательного деления клетки комплексом ферментов – метилазы Mut H, Mut h, MutS и Mut V. Первый из них «метит» те участки матричной («материнской») цепи ДНК, которые состоят из последовательности ЦТАГ – присоединяет к аденину (А) метильную группу СН3. Четыре других обнаруживают дефект в дочерней нити на участке между двумя соседними метками и исправляют её. В этой операции добавочно используются фермент хеликаза (расплетающая нить ДНК) и дезоксирибонуклеотидтрифосфат, заделывающий брешь после удаления ошибочного нуклеотида. 7. Пострепликативная, или рекомбинационная репарация. Данный вид репарации возникает тогда, когда клетка подошла в своём развитии к началу митоза (деления), а повреждения, отмеченные выше в разделах 1-4, ещё не устранены. В этом случае процесс репликации начинается на повреждённой матричной ДНК. Доходя до повреждённого нуклеотида, ДНК-полимераза застывает на месте, но не долее, чем на 10 секунд. Через 10 секунд она перескакивает через повреждённый нуклеотид, формируя дочернюю ДНК с брешами против дефектного нуклеотида. Надо сказать, что вторая дочерняя ДНК в этом месте формируется без дефекта, что и используется для исправления повреждённой ферментами recА и лигазами. 8.SOS-репарация. Этот способ сохранения жизнедеятельности дочерних клеток в том случае, когда ни один из перечисленных выше методов восстановления ДНК не сработал, а молекула начала делиться на две. Суть его заключается в том, что при неисправленных ДНК происходит синтез дополнительных белков, которые «загрубляют» деятельность ДНК-полимеразного комплекса до такой степени, что он «не замечает» наличие дефектов в матричной ДНК и продолжает строить дочерние с ошибками (мутациями). Таким образом, на некоторое время жизнедеятельность клеток сохраняется, хотя и в болезненном виде. Название «SOS-репарация» и дано по аналогии с ситуацией, связанной с подачей сигнала SOS, когда важно спасти гибнущего человека любой ценой. В дальнейшем дефектные дочерние клетки либо гибнут, либо успевают в ходе своего жизненного цикла устранить унаследованные дефекты ДНК. Впрочем, возможен и промежуточный результат – дефектные клетки продолжают размножаться. Особенно опасен такой результат для многоклеточных организмов, порождая в них болезненные, в том числе злокачественные процессы. Тем не менее, всё сказанное свидетельствует о том, что длительная эволюция живых организмов позволила создать весьма совершенный механизм сохранения наследственной информации. Но кроме внутриклеточного механизма важную роль играет внешний, приспособительный механизм поддержания наследственных признаков. Он связан с постоянной необходимостью приспосабливаться к изменяющейся внешней среде. Как уже указывалось выше (см. §5.2), для каждой популяции условия внешней среды обязательно будут изменяться, даже если в этой среде ничего не происходит, вследствие того, что эта популяция размножается в геометрической прогрессии. Как известно, Ч.Дарвин и А.Уоллес предложили схему приспособления организма к изменяющимся условиям внешней среды, именуемую «естественным отбором». Суть её заключается в том, что дефекты наследственности ДНК, передаваемые с помощью SOS-репарации, не всегда носят ущербный характер. Иногда они улучшают степень приспособленности клеток (или образованного ими многоклеточного организма) к условиям окружающей среды. Такие клетки выживают, а менее приспособленные гибнут. Основной логический недостаток такого объяснения заключается в том, что случайные повреждения ДНК даже в том случае, если они культивируются благоприятной внешней средой, не в состоянии «изобрести» весь тот необычайно сложный и совершенный мир живых организмов, который сформировался на Земле. Поэтому учёные–биологи и продолжают искать более целенаправленные механизмы развития биологических систем. В последние годы обнаружено, что молекулы ДНК, как прокариотов, так и эукариотов (включая, естественно, и все многоклеточные организмы) обладают способностью к активной перестройке – изменению последовательности и даже увеличению числа нуклеотидных пар. Такое изменение происходит как в наследственных, половых клетках, так и в соматических, т.е. предназначенных только для обеспечения жизнедеятельности многоклеточных организмов. Перестройка осуществляется с помощью так называемых подвижных элементов [59-62] ДНК. В 70-е годы двадцатого столетия было обнаружено, что отдельные фрагменты дуплексной структуры ДНК длиной от 103 до 105 пар нуклеотидов могут перемещаться вдоль самой молекулы или переходить на другую молекулу. Такая транспозиция приводит к мутациям геномов, однако в отличие от физико- или химикогенных (т.е. вызванных облучением или химическими реагентами), эти мутации обусловлены запрограммированными жизненными процессами, а не стохастическими и направленными на разрушение организма воздействиями. Согласно современным данным, подвижные элементы составляют от 10 до 30% всей массы ДНК. Их специфическая деятельность – перемещение в геноме – происходит относительно редко. Так, у плодовой мушки дрозофилы (наиболее удобного объекта изучения механизма генной жизнедеятельности) частота транспозиций не превышает 10-4 ... 10-6 (одна транспозиция на десять тысяч ... один миллион особей). Однако под воздействием изменения внешних условий эта частота может резко возрасти – 10-1 ... 10-2. Поведение подвижных элементов внутри ДНК напоминает поведение инородного фактора, озабоченного лишь самосохранением путём паразитирования и размножения в геноме. Одно время биологам представлялось, что основная часть молекулы ДНК – “хозяйский геном” – вынуждена бороться с ними. Во всяком случае, их поведение по подавляющему большинству признаков совпадало с деятельностью вирусов. Последние, как известно, представляют собой молекулу ДНК (или РНК), покрытую небольшой защитной белковой оболочкой, которая, проникнув в эукариотическую клетку, сбрасывает эту оболочку и “приклеивается” к молекуле ДНК поражённой ею “хозяйки”. А дальше вирусный участок соединённой ДНК порождает с помощью ферментов хозяйской клетки копии. Эти копии угнетают клетку-хозяйку, потребляя на своё образование значительную часть энергии и жизненного материала. После гибели клетки они в значительно большем количестве вываливаются из разорвавшейся оболочки и атакуют соседние клетки, проделывая с ними то же самое, что и с исходной. Впрочем, молекулы ДНК некоторых вирусов, присоединившись к хозяйской, как бы замирают: в течение длительного времени их копии не порождаются. Так, например, ведут себя внутри нейронов человека вирусы герпеса. И лишь при особых внешних условиях – ослаблении иммунной реакции организма – они выявляют свои злокачественные вирусные свойства. Однако, как показали самые последние исследования, целевая направленность подвижных элементов ДНК – транспозонов – совсем не та, что у вирусов. Всё более складывается мнение, что их основная функция – сохранение основного наследственного генофонда путём относительно небольшой перестройки генома применительно к изменяющимся внешним условиям. Различные подвижные элементы получают весьма живописные названия, например, hobo – бродяга, gypsy – цыган, flea – блоха и т.п. Они подразделяются на два класса – собственно транспозоны и ретротранспозоны. Транспозоны с помощью комплекса ферментов, главным из которых является транспозаза, вырезаются из одного участка ДНК и переносятся на другой. Вырезанный участок ДНК восстанавливается с помощью либо сестринской молекулы (при репликации), либо гомологичной. Таким образом, при перемещении транспозона число его копий в пределах ДНК возрастает на одну, а сама молекула увеличивается в размере. Ретротранспозоны не вырезаются из хромосомы, а перемещаются с помощью двух транспозиций – сначала по стандартной методике на заданном участке ДНК строится молекула мРНК, а затем по ней восстанавливается в конце хозяйской молекулы ДНК этот участок. При этом молекула мРНК ведёт себя как вирус. Более того, эта молекула может быть упакована в белковую оболочку, выйти из клетки и переместиться в другую клетку. Таким образом, генетический материал оказывается переданным неполовым путём от одного организма к другому. В частности, так могут возникнуть одноклетки. Обнаруживаются транспозоны в нити ДНК с помощью так называемых инвертированных повторов. Участок, соответствующий транспозону, с двух сторон ограничен пятью парами нуклеотидов с противоположной последовательностью (рисунок 5.9)
ДНК инвертированные инвертированные ДНК хозяина повторы транспозон повторы хозяина
Рисунок 5.9 Конструкция участка ДНК с транспозоном Хотя роль транспозонов и ретротранспозонов до конца ещё не изучена, уже сейчас явно, что она является важной, если не решающей в эволюционном процессе биологических систем. Во всяком случае, экспериментально доказано, что: 1.ретротранспозоны предохраняют ДНК от деградации, которая происходит при многократных делениях клеток; 2.транспозоны и ретротранспозоны влияют на интенсивность транскрипции генов, т.е. интенсивность генерирования экспрессии того или иного белка; 3.подвижные элементы ДНК влияют на процесс перекрёстного обмена участков гомологичных хромосом после слияния половых клеток (мейоза) – кроссинговера (см. §5.6); 4.ретротранспозоны могут выступать в роли вирусов и осуществлять перенос генов от одного многоклеточного организма другому; 5.Все эукариотические клетки обладают белковым механизмом активизации и, наоборот, торможения деятельности подвижных элементов; 6.Подвижные элементы ДНК могут: - удалить какой-либо ген из генома; - увеличить количество копий гена (амплификация); - состыковать разобщённые части гена.
Генная инженерия
Материал предыдущего параграфа показывает, что человеку удалось освоить естественный механизм перестройки молекулы ДНК, сохраняющий её жизненные основные функции – способность к репликации (удвоению) и транскрипции (считыванию наследственной информации путём построения молекулы мРНК). Эти знания всё чаще используются для исправления врождённых дефектов ДНК и, следовательно, лечения наследственных болезней у человека, а также усовершенствования полезных для человека качеств домашних животных и сельскохозяйственных растений. Порождённые современной генетикой технологии получили обобщённое название генная инженерия. Генная инженерия включает в себя следующие компоненты: 1.Создание банка данных расшифрованных (секвенированных) последовательностей аминокислот в белках и соответствующих генов в ДНК. В конце 1997г. [57] крупнейшие международные банки данных содержали сведения об 1.6 млн. генов и других фрагментов и о более 100 тыс. белков. 2.Разработка методов внесения ДНК в клетки. 3.Разработка методов интеграции внесённого гена в геном (устойчивого сохранения «лечебного» гена в хозяйской ДНК при всех последующих репликациях). 4.Исключение вредных побочных эффектов, т.е. влияния жизнедеятельности внесённого гена на активность хозяйских генов. Основной и, по-видимому, наиболее перспективный метод внесения изменений в ДНК эукариотических клеток – превращение вносимых участков в псевдовирусы, механизм действия которых описан в предыдущем параграфе. В настоящее время такие рекомбинантные вирусы подразделяются, по аналогии с настоящими вирусами на аденовирусы и ретровирусы, наследственная информация которых заключена, соответственно, в ДНК и РНК. Включение их в ДНК-хозяина осуществляется так же, как транспозонов и ретротранспозонов в естественных условиях (см. предыдущий параграф). Кроме этого метода известны другие: – химические (к очищенной от клетки молекуле ДНК добавляются ионы Ca++ или некоторые другие катионы, после чего молекула поглощается исправляемой клеткой), – физические: электропорация – создание микропор в мембране клетки электрическим разрядом, микроинъекция – внедрение ДНК в клетку микроскопическими стеклянными пипетками, простая инъекция – раствор ДНК впрыскивается шприцем и иглой в залечиваемую ткань, бомбардировка клеток микроскопическими металлическими «пулями» с наклеенными на них молекулами ДНК, – биологические (слияние с плазматической мембраной клетки липосом – искусственных липидных пузырьков с ДНК ). Генная инженерия в настоящее время более всего используется для лечения соматических клеток, т.е. организмов животных и растений. К их числу относятся наследственный иммунодефицит, лизосомная болезнь накопления (болезнь Гоше), семейная гиперхолестиринимия, гемофилин, талассимин, муковисаидоз, прогрессирующая дистрофия мышц Дюшенна. Несколько меньше известны результаты использования метода изменения наследственной информации гамет. Тем не менее, уже с 1985 года успешно проводятся эксперименты с целью улучшения полезных для человека свойств сельскохозяйственных животных и растений. Такие живые организмы именуются трансгенными [63]. Достаточно сказать, что в США в 1998 году площадь, засеянная трансгенными сельскохозяйственными культурами, составляла 24 млн. га. Динамика роста объёмов выращиваемых генно-инженерных растений составляет 2.5 ÷ 3-кратное увеличение в год (от 1.2 млн. га в 1996г до 70 млн. га в 1999г.). Основными трансгенными культурами являются кукуруза и соя с увеличенным содержанием белков, хлопчатник с повышенной устойчивостью к гербицидам и насекомым, а также с окрашенными в различные цвета волокнами. Получены коммерческие продукты с высококачественными растительными жирами и сахаридами. Но, пожалуй, наиболее интенсивно развиваются генные технологии создания лекарственных растительных препаратов. Такие препараты могут быть использованы (и уже используются) для лечения врождённых, заразных и злокачественных заболеваний.
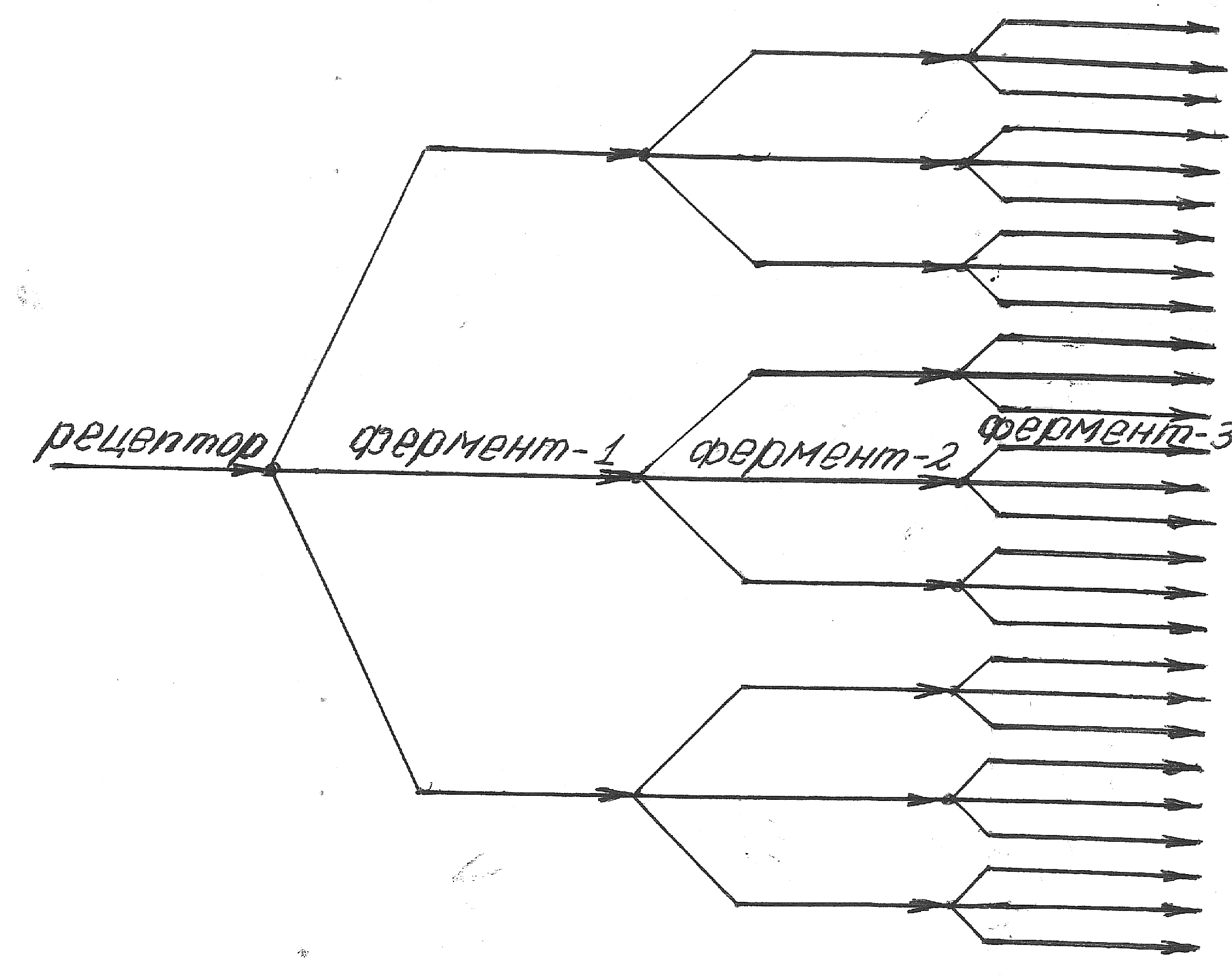
Управление в клетке Процессы управления в клетке осуществляется по тем же законам, что и в других управляемых системах (см.§5.2). В качестве эталонного органа выступает хромосома и ее узловая молекула – ДНК. Роль всех других органов – измерительного, усилительного, сравнения и исполнительного – играют белковые комплексы, сформированные описанным в предыдущем параграфе методом. В качестве измерительного органа выступают молекулы белков-рецепторов. Эти молекулы встроены в оболочку (мембрану) клетки таким образом, что их чувствительный конец находится снаружи, а ферментативный (воздействующий на другие белки) - внутри. Определённые вещества в окружающей клетку среде воздействуют на вполне определённые рецепторы, вызывая различную реакцию в организме клетки. Так, например, у многих клеток имеются жгутики, вращая которыми по или против часовой стрелки, клетка либо кувыркается, либо двигается поступательно. Положение клетки после кувыркания произвольное. Поэтому после него она двигается поступательно в произвольную сторону, как броуновская частица. Но если рецепторы сигнализируют, что она удаляется из среды с высокой концентрацией привлекательного для неё вещества (аттрактанта) или внедряется в среду с неблагоприятным веществом (репеллентом), она вновь начинает кувыркаться. В результате у её “броуновского движения” появляется упорядочивающий вектор, либо приводящий её в раствор с повышенной концентрацией аттрактанта, либо с пониженной концентрацией репеллента. Напомним, что инициаторами такого движения служат соответствующие белки-рецепторы. Механизм их воздействия на процессы в клетке следующий. Приведенный в активное состояние рецептор инициирует активность молекул вполне определённых белков-ферментов. Те в свою очередь следующих:
Так оказываются активированы миллионы молекул. Нетрудно видеть, что этот каскад ферментов играет роль усилительного органа - см. §4.2. Последняя ступень каскада воздействует на механический или химический исполнительный орган, например, на находящиеся под мембраной роторы жгутиков [38]. Один каскад вызывает вращение роторов против часовой стрелки и кувыркание клеток, другой – по часовой стрелке и поступательное движение. Другим примером исполнительного органа являются молекулы фибриногена – белка, превращающегося в фибрен – белок свёртывания крови, сгусток которого закупоривает раненый кровеносный сосуд [2]. Одновременно с включением исполнительного органа инициируется обратная цепочка каталитических реакций, прекращающих активность фермента 1:
Всего в клетке существует три основные системы управления (регуляции [39]): метаболическая (связанная с обменом веществ), генетическая (связанная с делением клетки) и мембранная (связанная с взаимодействием с внешним миром – движением, защитой от стрессовых состояний, поглощением и выбросом различных веществ). Рассмотрим в качестве ещё одного примера мембранного управления действие генетической системы у соматических клеток многоклеточных организмов. В этих клетках есть белок ras[2]. Он находится в активном состоянии, если к нему присоединена небольшая молекула Х2, и в неактивном - если Х1.. Обычно белок ras находится в соединении с Х1, т.е. в неактивной форме. После воздействия внешних факторов, – например, специальных гормонов, управляющих многоклеточным организмом, молекула Х1 превращается в Х2 и ras становится активным. Он вызывает активизацию фермента Е, который даёт сигнал делению клетки. Молекула Х2 имеет свойство довольно быстро снова превращаться в Х1. Тем самым белок ras возвращается в неактивное состояние. Как видим, деление клетки в многоклеточном организме происходит по команде из его центра управления. Правда, у некоторых клеток при неблагоприятном воздействии окружающей среды происходит деформация молекулы ras и Х2 не превращается в Х1. В результате утрачивается внешнее управление клеткой, и она начинает бесконтрольно делиться. Такое “антисоциальное” поведение клеток вызывает появление злокачественных опухолей [40].
Поиск по сайту: |