 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Вплив температури на швидкість реакції
Підвищення температури реагуючих речовин внаслідок збільшення швидкості молекул приводить до зростання загальної енергії системи і відповідно до збільшення відносного вмісту активних молекул, що рівнозначно зростанню швидкості хімічної реакції. Вплив температури і енергії активації на швидкість хімічних реакцій можна виразити за допомогою залежності константи швидкості реакції k від температури Т і ∆Еакт:
де А — множник Арреніуса, пропорційний числу зіткнень молекул. Якщо концентрації реагуючих речовин дорівнюють 1 моль/л, то рівняння Арреніуса (4) дає змогу виразити залежність швидкості реакцій від температури:
Оскільки в рівнянні (5) температура входить у показник степені, то швидкість хімічних реакцій дуже залежить від зміни температури. Експериментально встановлено, що залежність швидкості хімічної реакції від температури можна виразити у вигляді емпіричного правила Вант-Гоффа: підвищення температури на кожні 10 градусів збільшує швидкість реакції приблизно в 2—4 рази. У математичній формі правило Вант-Гоффа записується так:
де ∆to— збільшення температури; v1 — швидкість реакції до підвищення температури; v2— швидкість реакції після підвищення температури (при температурі t2); γ— температурний коефіцієнт швидкості реакції (γ == 2—4). Рівняння (6) є приблизним, тому що швидкість реакції крім температури залежить також від енергії активації ∆Еакт, яка, в свою чергу, залежить від температури. Каталіз Швидкість хімічних процесів можна значно збільшити завдяки введенню у реакційну систему певних речовин, які називаються каталізаторами. Каталізатор — це речовина, що збільшує швидкість реакції, кількісно і якісно при цьому не змінюючись. Речовини, які уповільнюють швидкість хімічних процесів, а самі при цьому не змінюються, називаються інгібіторами. З наведеного визначення може здатись, що каталізатор не бере участі в хімічній взаємодії речовин. Експериментально доведено, що каталізатор тільки кількісно не змінюється під час реакції, але бере участь у проміжних стадіях хімічної взаємодії і саме завдяки ньому збільшує. швидкість хімічних реакцій. Механізм дії каталізаторів різний. Найпоширенішою формою дії каталізатора є утворення проміжних сполук з реагуючими речовинами. Зміна швидкості при цьому пояснюється зменшенням енергії активації. Розглянемо механізм дії каталізатора з погляду утворення проміжних сполук на прикладі взаємодії речовин А і В з утворенням сполуки АВ. Нехайё сполука утворюється через активний комплекс А---В, енергія активаціїякого ∆Еакт: ∆Еакт А+В → А ••• В → АВ.
Як правило, для каталітичних процесів енергія активації ∆Еакт має досить високе значення. Тому речовини А і В взаємодіють з дуже малою швидкістю або зовсім не взаємодіють. Можливий інший спосіб утворення сполуки АВ. Нехай є речовина К, яка дуже легко вступає у взаємодію з речовиною А: ∆Е/акт А+К → А ••• К → АК. Легкість взаємодії А і К означає, що енергія її активації ∆Е/акт мала, а Рис. 3. Енергетична схема взаємодії речо- швидкість велика. вин А і В з каталізатором К (/) та без ка- В свою чергу, сполука АК легко талізатора (2). взаємодіє з речовиною В, утворюючи АВ і К: ∆Е//акт АК + В → АК ••• В → АВ + К. Отже, внаслідок реакції речовина (каталізатор) залишилась без зміни і утворилась сполука АВ. Енергетична схема двох способів взаємодії А і В (рис. 3) показує, що при наявності каталізатора енергія активації реакції зменшується. Відповідно до рівняння (5) енергія активації входить у показник степеня з від'ємним знаком і тому навіть незначна її зміна приводить до значного збільшення швидкості реакції. За своїм агрегатним станом каталізатори можуть бути твердими (Pt, Fe, Co, Ni, V2O5), рідкими і газоподібними (NО2). У зв'язку з цим каталітичні процеси поділяють на гомогенні і гетерогенні. При гомогенному каталізі всі реагуючі речовини і каталізатор утворюють одну фазу (газоподібну або рідку). Прикладом гомогенного каталізу є окислення CO в газоподібній фазі при наявності пари води як каталізатора. Основою добування сірчаної кислоти баштовим методом також є гомогенна каталітична реакція H2SO3 + NO2 == H2SO4 +NO, яка може відбуватися як у рідкій, так і в газоподібній фазах. При гетерогенному каталізі каталізатор утворює самостійну, як правило, тверду фазу, на поверхні якої відбуваються каталітичні процеси. Прикладом гетерогенного каталітичного процесу може бути окислення SO2 до SO3 на поверхні V2O5. Важливою особливістю каталітичних процесів є специфічність дії каталізатора. Крім каталізаторів, здатних прискорювати лише одну реакцію, є каталізатори, які прискорюють цілу групу аналогічних реакцій. Наприклад, платина, нікель ї паладій досить добре каталізують реакції приєднання водню. Залежно від природи каталізатора, можна спрямувати взаємодію тих самих речовин у різному напрямі. Так, при наявності АІ2О3 метиловий спирт розкладається на Н2О і С2Н2, а при наявності залізо-мідного каталізатора СН3ОН утворює альдегід і водень. Каталітичні процеси мають велике практичне значення. Значна частина продуктів сучасної хімічної промисловості виробляється на основі каталітичних реакцій. До каталітичних процесів належать синтез аміаку (каталізатор залізо) і метанолу, окислення SO2 до SO3(каталізатор V2O5), окислення МН3 до NO (каталізатор платина), добування поліетилену та інших полімерних матеріалів. Велику роль відіграють каталізатори в фізіологічних процесах, що відбуваються в рослинних і тваринних клітинах. Як каталізатори в живих клітинах виступають різного типу ферменти. Хімічна рівновага При вивченні основних закономірностей рівноважних процесів насамперед розглядають поняття про оборотні і необоротні реакції і оборотність хімічних процесів. Необоротними хімічними реакціями називаються реакції, які відбуваються лише в одному напрямі. З погляду термодинаміки, відповідно до рівняння для ізобарного потенціалу ∆G=∆H-T∆S необоротні процеси відбуваються із зменшенням ентальпії (—∆H) і збільшенням ентропії (+∆S). Це означає, що ізобарний потенціал ∆G за будь-яких умов (концентрація реагуючих речовин і температура) завжди матиме від'ємне значення і реакція відбуватиметься тільки в одному напрямі. До необоротних реакцій належать, наприклад, розкладання перманганату калію при нагріванні: 2КМп04 = К2МпО4 + МпО2 + 02, розкладаннябертолетової солі за рівнянням 2КС103=2КС1+302, або взаємодія лужних металів з водою за рівнянням 2К + Н2О = 2КОН + Н2 та багато інших процесів. Оборотними називаються реакції, які можуть відбуватися в прямому і в зворотному напрямах. Оборотні реакції відбуваються, як правило, із зменшенням ентальпії (—∆H )і ентропії (—∆S) системи. З рівняння ∆G=∆H-T∆S видно, що залежно від температури величина ізобарного потенціалу ∆G може мати або від'ємне (переважає ентальпійний фактор), або при високих температурах додатне значення (переважає ентропійний фактор). Для таких процесів за певних умов можлива пряма реакція або зворотна. До оборотних реакцій належить, наприклад, взаємодія кисню з воднем: 2Н2+О2⇄2Н2О Справді, при температурах 800—1500° С кисень з воднем утворюють воду, взаємодіючи досить бурхливо. При температурах 3000—4000е С навпаки, вода розкладається з утворенням Н2 і О2. Взаємодія йоду з воднем за рівнянням Н2 + І2 ⇄2НІ відбувається при температурах 300—400° С. При тих самих температуpax можлива і зворотна реакція розкладання йодоводню.
Більшість хімічних реакцій є оборотними, тобто можуть відбуватися в прямому і зворотному напрямах. Одні реакції відбуваються за умов, в яких зворотна реакція неможлива (взаємодія Н2 і О2), для інших можливий перебіг як прямої, так і зворотної реакцій (взаємодія Н2 і І2). В обох наведених прикладах можна виявити зворотну реакцію і навіть виміряти швидкості прямої і зворотної реакцій. Є також умови,
за яких одночасно відбуваються пряма і зворотна реакції. Проте відомі процеси, для яких виміряти швидкість зворотної реакції неможливо і тому можна лише говорити про оборотність процесу. Якою мірою той чи інший процес оборотний залежить від природи реагуючих речовин і умов, за яких відбувається реакція Розглянемо докладніше оборотні реакції, які одночасно за певних умов відбуваються в обох напрямах. До таких реакцій, як уже зазначалось, належить взаємодія Н2 і І2 при 300—400° С: Н2 + І2 ⇄2НІ У перший момент швидкість прямої реакції
визначається початковими концентраціями вихідних речовин. Швидкість зворотної реакції при цьому дорівнює нулю. В міру взаємодії Н2 і I2 і утворення НІ швидкість прямої реакції зменшуватиметься, а швидкість зворотної реакції
зростатиме. Через деякий час швидкості прямої і зворотної реакцій зрівняються (рис. 4). При цьому кількість утворених молекул НІ дорівнюватиме кількості молекул НІ, яка розклалася. Тобто концентрації всіх речовин у момент, коли швидкості прямої і зворотної реакцій однакові, не змінюються. Такий стан реакційної системи називається хімічною рівновагою. При хімічній рівновазі склад системи не змінюється, оскільки в системі відбувається хімічна взаємодія в обох напрямах з однаковою швидкістю. Тому хімічна рівновага має також назву динамічної рівноваги. У момент хімічної рівноваги, коли швидкості прямої і зворотної реакцій однакові, можна записати:
або
звідки
При даній температурі константи швидкості k1 і k2 є величини сталі, тому їх відношення К. = k1/k2 теж величина стала. Тоді
де K— константа хімічної рівноваги. Квадратними дужками позначають рівноважні концентрації речовин. У виразі для константи рівноваги (7) у чисельнику записують концентрації продуктів реакції, а у знаменнику - концентрації реагуючих речовин, причому беруть рівноважні концентрації. Для зворотної реакції аА+bВ ⇄eE+dD константа рівноваги
У вираз константи хімічної рівноваги, як і у вираз константи швидкості, концентрації входять у степенях, які дорівнюють стехіометричним коефіцієнтам у рівнянні реакції. Рівняння (8) є одним з виразів закону діючих мас. Слід зауважити, що закон діючих мас справедливий і для гетерогенних систем, але тільки для однорідних їх частин. Наприклад, для гетерогенної системи С(т) + СО2 (г) ⇄ 2СО(г) у відповідності до закону діючих мас для швидкості прямої реакції можемо записати:
Вираз константи рівноваги для даної системи буде мати вигляд:
Константа хімічної рівноваги показує, що в момент рівноваги відношення добутку рівноважних концентрацій продуктівреакціїдо добутку рівноважних концентрацій реагуючих речовин є величиною сталою при Т == const. Тобто незалежно від початкових концентрацій рівновага в системі встановлюється завжди при тому самому відношенні концентрацій продуктів реакції і реагуючих речовин. Це співідношення не залежить від того, які речовини беруться як вихідні, наприклад Н2 + I2 або НІ.
Поиск по сайту: |
 , (4)
, (4) (5)
(5) (6)
(6)




 =
= 
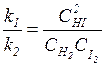
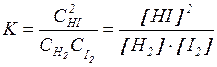 , (7)
, (7) , (8)
, (8) .
.