 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ. 4.1 Разложение пероксида водорода в присутствии диоксида марганца MnO2.
4.1 Разложение пероксида водорода в присутствии диоксида марганца MnO2.
Перед началом опыта необходимо подготовить катализатор: небольшой кусочек стеклянной палочки смазать клеем БФ или крахмальным клейстером. Необходимо смазать клеем только торец, немного порошка MnO2 насыпать на часовое стекло, прикоснуться торцом палочки к порошку, чтобы небольшое количество MnO2 осталось на стекле. Клей Высушивают в течение нескольких минут (1-2 мин). Давление внутри системы для сбора Н2О2 необходимо привести к атмосферному: открыть пробку реакционной пробирки, с помощью уравнительной склянки установит уровень воды в бюретке на нулевую отметку. Схема прибора для измерения скорости разложения Н2О2 представле-на рис.1.
Рис.1 – Прибор для изучения кинетики разложения Н2О2.
Пипеткой или мерным цилиндром отмеряют 2 мл 3 %-ного раствора Н2О2, выливают в пробирку 1. Если опыт проводится при комнатной температуре, готовят секундомер, таблицу для записи опытных данных, Опускают в пробирку катализатор, нанесенный на кусочек стеклянной палочки. Закрывают реакционный сосуд пробкой. Записывают объем выделяющегося кислорода сначала через 30 сек, затем интервал можно увеличить до 1 мин. По мере понижения уровня жидкости в бюретке уравнительную склянку опускают так, чтобы уровень жидкости в бюретке и склянке не изменялся, разность уровней была минимальной. Реакция считается законченной, если уровень жидкости в бюретке перестает опускаться. Объем кислорода, соответствующий полному разложению Н2О2 –V¥, можно получить, если реакционный сосуд поместить в стакан с горячей водой. После охлаждения пробирки до комнатной температуры. После определяют объем О2, соответствующий полному разложению Н2О2.
Таблица – Экспериментальные данные
По результатам эксперимента вычисляют среднее значение константы скорости реакции. Полагая, что порядок реакции первый, константу скорости реакции вычисляют по кинетическому уравнению первого порядка: k = 1/t·ln По результатам эксперимента вычисляют среднее значение константы скорости реакции. Период полураспада пероксида водорода вычисляют по уравнению: t0,5 = 0,693/k, используя среднее значение константы скорости. Определяют константу скорости и период полураспада графически, используя зависимость Vt= f (t) и ln(V¥ – Vt) = f (t), которые представлены на рис.2 и рис. 3. Сравнивают результаты, полученные двумя методами – аналитическим и графическим.
V¥
α
t, минt t,мин Рис. 2 –Зависимость Vt = f(t) Рис.3 – Зависимость ln(V¥ – Vt) = f(t) 4.2 Разложение пероксида водорода в присутствии катализатора при температуре Т2
Опыт повторяют, поместив реакционный сосуд в водяную баню или стакан с водой при температуре Т2 (по указанию преподавателя). Данные заносят в таблицу: Зная константы скорости k1 и k2 при двух различных температурах, можно вычислить энергию активации Еa по уравнению Аррениуса: Еа = Кроме того, можно вычислить температурный коэффициент по правилу Вант-Гоффа: k2/k1 = γ ∆t/10
Поиск по сайту: |


 уравнительн. склянка
уравнительн. склянка












 пробирка с Н2О2
пробирка с Н2О2





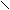


 катализатор
катализатор

 V, мл lg (V¥ – Vt )
V, мл lg (V¥ – Vt )




