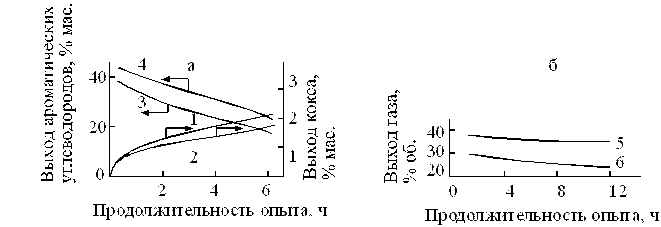|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Состав катализаторов риформинга
Катализатор риформинга представляет собой активную фазу, содержащую платину, промотор, а в последнее время часто и третий компонент – модификатор, нанесенные на носитель. В качестве носителя используется g- и h- А12О3. Удельная площадь поверхности составляет 200 – 300 м2/г. Сохраняется при прокаливании до 8000С. Прокаленный активный оксид алюминия содержит до 5 % воды. Молекулы Н2О по мере повышения температуры прокаливания реагируют с А12О3 и образуют поверхностные гидроксильные группы. При дальнейшем прокаливании они постепенно удаляются в виде Н2О. Установлено, что кислотность А12О3 в основном обусловлена апротонными льюисовскими кислотными центрами. Кислотность и активность А12О3 имеют общий максимум, который проявляется после прокаливания при 400 – 5000С. Сила кислотных центров увеличивается при хлорировании А12О3. Благодаря перераспределению электронов увеличивается кислотность группы -ОН и подвижность водорода:
Первые алюмоплатиновые катализаторы риформинга содержали » 0,6 % платины на окисле алюминия, модифицированном фтором, а в последствие – хлором. В1968 г. появился патент на первый промышленный биметаллический (платинорениевый) катализатор. С того времени опубликована обширная патентная литература по полиметаллическим катализаторам риформинга, которая служит важным источником информации об их составе. Судя по патентным данным, для промотирования алюмоплатинового катализатора можно использовать многие металлы I –VШ групп периодической системы элементов, исключая щелочные и щелочно-земельные металлы. Однако по количеству взятых патентов резко выделяются Ge, Sn, Ir, Re, что указывает на использование этих металлов для промотирования промышленных катализаторов риформинга. Используемые для промотирования металлы можно разделить на две группы. К первой из них принадлежат иридий и рений, хорошо известные как катализаторы гидро-дегидрогенизации и гидрогенолиза. Другая, более обширная группа промоторов, включает металлы, которые практически не активны в указанных реакциях. Такими металлами являются Cu, Cd, Ge, Sn, Pb и др. Некоторые из этих металлов давно известны как каталитические яды для платины. В последнее время наблюдается стремление улучшить катализаторы риформинга за счет перехода от биметаллических к полиметаллическим каталитическим системам. Большей частью такие системы содержат, наряду с платиной, еще два элемента, из которых один принадлежит к первой группе, а другой – ко второй. В качестве кислотного компонента в полиметаллических катализаторах используется только хлор. Ge, Sn и Pb проявляют значительное сходство в отношении характера своего действия на алюмоплатиновый катализатор (АПК). Было изучено влияние олова и свинца на активность и селективность АПК в реакциях дегидрирования циклогексана и дегидроциклизации н-гептана (рис.2.4, 2.5). При 3150С увеличение отношения Sn : Pt или Pb : Pt приводит к резкому снижению активности катализатора в реакции дегидрирования циклогексана, вплоть до полной его дезактивации. Поскольку при такой низкой температуре зауглероживание катализатора практически не происходит, следует полагать, что падение его активности вызвано отравлением как оловом, так и свинцом. Отравление происходит вследствие непосредственного взаимодействия платины и олова или платины и свинца, которое приводит к химическому модифицированию платиновых кластеров. Иная картина наблюдается, когда реакции дегидрирования циклогексана и дегидроциклизации н-гептана протекают в условиях (высокие температуры, низкое давление водорода), при которых на катализаторе происходит образование кокса. В этом случае кривые выхода ароматических углеводородов в зависимости от отношения
Однако, если коксоотложение практически подавлено, избыточное содержание олова или свинца в катализаторе должно привести к его отравлению, а следовательно, и к снижению его активности, как это происходит при низкой температуре, когда катализатор не подвергается зауглероживанию Анализируя причины влияния модифицирующего элемента на активность и селективность нанесенных платиновых катализаторов в реакциях превращения гексана Маслянский и Шапиро пришли к выводу, что оно связано скорее всего с изменением прочности связи углерод – металл.
Р и с. 2.5. Зависимость состава продуктов превращения н-гептана от атомного отношения Pb:Pt или Sn:Pt в катализаторе: катализатор 0,35 % Pt /η-Al2O3: 1 – степень превращения; 2 – выход толуола; 3 – выход продуктов крекинга.
На рис. 2.6 приведены результаты испытания АПК и АПК, модифицированного оловом, в превращении н-гексана. Показано, что добавка 0,35 % олова в АПК повышает селективность его работы: повышается выход бензола, снижается закоксованность и выход газа. Эти данные согласуются с результатами, описанными выше.
Р и с. 2. 6. Влияние состава катализаторов и продолжительности опыта на выход продуктов превращения н-гептана - ароматических углеводородов и кокса (а), газа (б). 1, 3, 5 – катализатор 0,6 % Pt/Al2O3; 2, 4, 6 - катализатор 0,6 % Pt+0,35 % Sn/Al2O3
Установлено, что дисперсность платины в катализаторах, модифицированных Sn и Ge, практически не уменьшается при закоксовывании. Это указывает на то, что платина не блокируется коксом. Исследования методом ДТА показали, что на термограмме отсутствует пик, отвечающий горению кокса в зоне платины. Таким образом, модифицирование алюмоплатинового катализатора германием или оловом приводит к росту стабильности вследствие предотвращения закоксованности платины. Этот эффект был объяснен как следствие отравления металлами IV группы центров прочной адсорбции на платине. Существуют факты, указывающие на то, что и оксид алюминия в АПК, промотированном оловом, коксуется меньше. Это объясняется спилловером водорода. Sn и Ge, предотвращая блокирование платины коксом, тем самым должны способствовать поддержанию высокой скорости спилловера водорода. При этом гидрирование поверхностных ненасыщенных соединений, склонных к образованию кокса на носителе, будет протекать с наибольшей интенсивностью вблизи кластеров платины. АПК, промотированные рением, нашли значительно более широкое промышленное применение, чем все другие би- и полиметаллические катализаторы риформинга. Большинство исследователей считают, что в восстановленном состоянии образуют сплав (биметаллические кластеры). Для подтверждения следует, прежде всего, сослаться на результаты, полученные при температурно-программированном восстановлении (ТПВ) промышленного катализатора Pt-Re/Al2O3. Платина и рений восстанавливаются в одном и том же интервале температур, характерном для платины, хотя температуры максимальных скоростей восстановления (пики на термограммах ТПВ) Pt/Al2O3 и Re/Al2O3 различаются почти на 3000С. То обстоятельство, что платина катализирует восстановление рения, указывает на наличие тесного контакта между этими металлами, а следовательно, и на возможность образования сплава между ними. Зависимость выхода ароматических соединений от состава платинорениевого катализатора исследовалась в риформинге бензиновой фракции (рис. 2.7) Показано, что при одинаковом общем содержании металлов (Pt или S Pt+Re) активность промотированного катализатора заметно выше. Высказывались предположения, что это может быть объяснено более высокой дисперсностью металлической фазы в промотированном катализаторе. Этим же, по-видимому, объясняется и значительно более высокая чувствительность промотированного катализатора к отравлению серой. Рений и металлы 1V группы (Sn, Ge) оказывают различное влияние на каталитические свойства АПК. Рений увеличивает активность катализатора в реакции гидрогенолиза, а олово и свинец, наоборот, подавляют эту активность. При относительно низких температурах (» 4000С) или повышенном содержании олово и свинец вызывают падение активности АПК в реакциях ароматизации углеводородов, что не наблюдается при использовании рения. Однако рений, как и металлы 1V группы, повышает стабильность АПК в условиях реакционного периода. Иридий, как и платина, катализирует различные превращения углеводородов. Сравнение катализаторов Pt/g- Al2O3 и Ir/g- Al2O3 в реакциях индивидуальных углеводородов показало, что платиновый катализатор обладает большей активностью и селективностью в реакциях ароматизации нафтенов, а иридиевый – в реакциях дегидроциклизации парафинов. Скорость гидрогенолиза на иридиевом катализаторе намного больше, а отложения кокса намного меньше.
Р и с . 2.7. Зависимость выхода суммы ароматических углеводородов от состава платинорениевого (1, 3) и платинового (2, 4) катализаторов: 1, 2 – γ – Al2O3; 3,4 – NiAl2O4.
Добавление иридия в АПК повышает его активность и стабильность при риформинге н-гептана. Промышленный катализатор Pt - Ir /g- Al2O3 (КХ-130) по активности и стабильности в условиях риформинга превосходит не только катализатор АПК, но и алюмоплатинорениевый (рис. 2.8). Высокая стабильность катализатора Pt - Ir /g- Al2O3 обусловлена тем, что скорость коксообразования на нем значительно меньше, чем на Pt /g- Al2O3 . Даже при незначительном содержании иридия в катализаторе подавляется коксообразование. Этот эффект можно объяснить тем, что образующиеся на платине ненасыщенные соединения, являющиеся источниками коксообразования, мигрируют к иридиевым поверхностным центрам, на которых подвергаются гидрированию или гидрогенолизу.
Р и с. 2.8. Активность и стабильность катализаторов Pt/Al2O3, Pt-Re/Al2O3, Pt-Ir/Al2O3 (КХ-130) при риформинге бензиновой фракции.
Pt - Ir /g- Al2O3 катализаторы нашли весьма ограниченное применение из-за чрезмерной чувствительности к условиям эксплуатации.
2.3. Стадии приготовление катализаторов риформинга и их влияние на каталитическую активность катализатора
2.3.1. Пропитка Для приготовления как моно-, так и полиметаллических катализаторов применяется платинохлористоводородная кислота H2PtCl6. Для нанесения иридия и рения также используются растворы соответствующих кислот: HReO4 и H2IrCl6. При внесении в разбавленный раствор H2PtCl6 гранул оксида алюминия происходит сорбция кислоты корочного типа. Это объясняется тем, что при малом содержании платины в катализаторе риформинга концентрация гидроксильных ионов в периферийном слое гранул оксида алюминия достаточна для того, чтобы в результате ионного обмена платина оказалась сосредоточенной в наружном слое гранулы. Это неравномерное распределение платины по внутренней поверхности оксида алюминия не является оптимальным. Для промышленных катализаторов риформинга характерно иное, относительно равномерное распределение платины и других активных компонентов. Для их приготовления используют метод, основанный на конкурентной сорбции, которая имеет место при введении в пропиточный раствор веществ, сорбирующихся на оксиде алюминия, как и соединения, содержащие платину, иридий и рений. При нанесении платины на оксид алюминия к раствору H2PtCl6 добавляют в качестве конкурирующих кислот уксусную, соляную, лимонную и др. кислоты. Конкурирующая кислота реагирует с поверхностными гидроксилами оксида алюминия, что приводит к уменьшению концентрации свободных гидроксилов. В результате H2PtCl6 диффундирует в толщу гранулы носителя, проникая в более глубокие ее слои. Следствием является увеличение дисперсности металла.
│-OH + H2PtCl6 ® │- HPtCl6 + H2O В растворе должно содержаться оптимальное количество конкурента. Если его больше, часть платины не сорбируется, а остается в растворе внутри пор. При сушке и восстановлении образуется более грубодисперсная платина. Она менее связана с поверхностью и легче спекается в процессе эксплуатации катализатора.
2.3.2. Сушка и прокаливание катализаторов Стадия сушки незначительно сказывается на распределении платины по грануле оксида алюминия. Это объясняется тем, что АПК – сорбционный. Длительное хранение высушенного АПК без прокаливания вызывает изменение его каталитических свойств. Катализатор прокаливают в токе воздуха при постепенном повышении температуры до 500 – 5200С. При этом протекают следующие реакции:
Выделяющийся НС1 связывается поверхностью оксида алюминия.
O2, H2O PtCl4 ® PtO2
Влияние температуры прокаливания катализаторов в разной среде на их дисперсность представлено на рис.2.9.
Рис. 2.9. Влияние термической обработки в кислороде (1, 2) и водороде (3, 4) на относительную дисперсию платины (Дзисько, с. 176) 1, 3 – катализатор 2 % Pt/Al2O3; 2, 4 – 2 % Ir/ Al2O3.
Повышение дисперсности частиц платины при прокаливании в кислороде объясняют по-разному. Называются следующие возможные причины: - растрескивание крупных кристаллов платины; - малый угол смачивания PtO2 оксида алюминия; - существование двумерного слоя жидкого оксида платины; - летучесть PtO2. Все эти процессы не имеют места в среде Н2.
Поиск по сайту: |