 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Кинетические уравнения для гетерогеннокаталитических реакций
Существуют [5] методы получения кинетических уравнений для реакций, протекающих в присутствии гетерогенных катализаторов. Их можно применить к случаям, когда лимитирующей стадией является адсорбция, десорбция или одна из стадий реакции на поверхности. В этом случае скорость реакции совпадает со скоростью самой медленной стадии. Остальные стадии можно считать равновесными и записать для них константы равновесия. Для простейшего случая мономолекулярной реакции A
v = где v – скорость реакции. Кинетический член содержит концентрацию активных центров, константу скорости лимитирующей стадии и в большинстве случаев адсорбционные константы. Этот член уравнения используется для сравнения каталитических свойств различных катализаторов. Адсорбционным членом описывается доля покрытия активных центров. Показатель степени n соответствует числу активных центров, участвующих в элементарной реакции. Потенциальный член характеризует движущую силу реакции удаление газовой фазы от состояния термодинамического равновесия. Хоуген и Уотсон вывели указанные члены для ряда механизмов реакций. В качестве примера в табл. 1 приведены некоторые системы уравнений для реакции A«R. Таблица 1. Кинетические уравнения Хоугена – Уотсона для реакции А«R.
Используемые обозначения: - bi -константа адсорбционного равновесия компонента i; - K - константа термодинамического равновесия; - k - константа скорости реакции; - pi - парциальное давление компонента i.
Диффузия и катализ. В том случае, когда наблюдаемые на опыте скорости каталитических процессов зависят от условий переноса вещества и тепла в газовой фазе или в порах катализатора, используют условный термин “макрокинетика“. Другими словами, здесь изучают зависимость скоростей химических реакций от макрофакторов – неоднородностей концентраций реагентов и температуры в зоне реакций, зависящих от условий диффузии, конвекции и теплопередачи. На опыте такие случаи отличаются по изменению скоростей реакций при изменении размера гранул катализатора, скорости газового потока и т.д. Протекание химической реакции охватывает как химические процессы, так и физические процессы. Если процессы диффузии происходят быстрее, чем химические реакции, то диффузия не влияет на суммарную скорость процесса. При этом концентрации реагентов в порах и над внешней поверхностью катализатора соответствуют их концентрациям в газовой фазе. Если же скорость диффузии сравнима со скоростью реакции, то последняя уменьшается вследствие неполноты массопереноса. В предельном случае скорость процесса может полностью определяться диффузией. Различают два вида диффузии: диффузию к внешней поверхности зерен катализатора (внешняя диффузия) и диффузию в порах (внутренняя диффузия). При изучении кинетики химической реакции влияние диффузии должно быть исключено. Из общих соображений ясно, что можно выделить четыре предельных случая, когда при заданных значениях скорости транспорта и каталитического превращения будут наблюдаться различные закономерности. 1. Внешняя диффузионная область наблюдается в тех случаях, когда скорость диффузии реагентов даже к легко доступным участкам катализатора (наружной поверхности гранул или к стенке) меньше скорости реакции на этих участках. При этом кинетические закономерности определяются законами транспорта вещества к поверхности катализатора. Градиент концентрации реагентов в газовой фазе велик, а катализ осуществляется на внешней поверхности гранул. 2. Внутренняя кинетическая область наблюдается в тех случаях, когла скорость транспорта реагентов к самым труднодоступным участкам поверхности катализатора превышает скорость химической реакции. Явления диффузии не искажают кинетические закономерности, относящиеся к адсорбции или катализу. Эффективна вся поверхность катализатора. Градиенты концентраций реагентов в газовой фазе и порах катализатора невелики. 3. Внешняя кинетическая область отвечает тем случаям, когда скорость диффузии к внешней поверхности гранул достаточно велика по сравнению со скоростью реакции на поверхности гранул, а эта последняя, в свою очередь, так велика, что основная масса реагентов претерпевает превращение на внешней поверхности гранул катализатора. Кинетические закономерности не осложнены диффузионными. Эффективно работает только внешняя поверхность гранул катализатора. Градиенты концентрации реагентов в газовой фазе малы, но они велики в устье пор катализатора. 4. Внутренняя диффузионная область наблюдается тогда, когда скорости диффузии в порах катализатора соизмеримы со скоростью каталитического превращения на стенках пор. Концентрации веществ на внешней поверхности пористого катализатора близки к концентрациям в объеме. Концентрации в порах уменьшаются от наружной поверхности зерна к центру. При понижении температуры можно достичь перехода реакции из внутренней диффузионной области в кинетическую. Такой переход можно осуществить также за счет изменения пористой структуры катализатора с одинаковыми удельными каталитическими характеристиками. Типичная форма зависимости логарифма константы скорости гетерогенного процесса от величины обратной температуры показана на рис. 9.
Рис.9. Зависимость логарифма кажущейся константы скорости от обратной температуры.
Лекция 5.
Поиск по сайту: |
 « R Хоугеном и Уотсоном предложены кинетические уравнения общего вида
« R Хоугеном и Уотсоном предложены кинетические уравнения общего вида ,
,
 +bRpR)
+bRpR)
 +bRpR)
+bRpR)
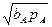 + bRpR)
+ bRpR)
