 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Математическое описание процесса адсорбции
В основе математического описания процесса адсорбции лежат уравнения изобар и изотерм адсорбции. 1. Изобары адсорбции. Изменение объема адсорбированного вещества как функция температуры при постоянном давлении. V = f (T) p. Из рисунка 2 видно, что при низких температурах имеет место лишь физическая адсорбция (АВ). Начиная с некоторой температуры нарастает активированная адсорбция, или хемосорбция (ВС). Скорость нарастания хемосорбции перекрывает скорость падения физической адсорбции. Далее с температурой снижается хемосорбция (CD).
Рис. 2. Соотношение изобар физической адсорбции и хемосорбции.
2. Изотермы адсорбции. V = f (P) T. Изменение объема адсорбированного вещества с изменением давления в системе при постоянной температуре. Существует несколько математических уравнений, описывающих изотермы адсорбции. Вывод этих уравнений основан на некоторых допущениях.
1). Уравнение Генри.
V = k P, Где V - объем адсорбированного вещества; P - давление; k - константа. Уравнение описывает хемосорбцию и физическую адсорбцию. Приняты следующие допущения: - адсорбированные вещества представляют собой двумерный идеальный газ; - адсорбированные молекулы не взаимодействуют друг с другом; - поверхность адсорбента энергетически однородна. Эта изотерма – предельный случай других уравнений адсорбции при крайне малых степенях покрытия. 2). Теоретически наиболее хорошо обосновано уравнение изотермы Лэнгмюра. Вывод уравнения основан на следующих допущениях: - поверхность адсорбента однородна; - взаимодействие между адсорбированными молекулами отсутствует; - адсорбция протекает до образования монослоя; - процесс динамичен, и при данных условиях устанавливается равновесие между адсорбцией и десорбцией.
где V -объем адсорбированного газа; V0 - объем газа, необходимый для образования монослоя; q - доля поверхности, покрытая слоем адсорбированного газа; b - адсорбционный коэффициент. Зависимость величины адсорбции от давления представлена на рисунке 3.
Рис. 3. Изотерма адсорбции Лэнгмюра.
Для кинетических закономерностей важны два предельных случая. Если вещество сорбируется слабо или давление в системе низкое, можно считать, что bP << 1. Тогда изотерма Лэнгмюра переходит в изотерму Генри:
q = bP.
Это начальный линейный участок кривой 1. При высоких давлениях или сильной адсорбции bP >> 1. Тогда lim q = 1, что отвечает образованию монослоя (состояние насыщения на кривой II).
3). Действительная форма изотермы физической адсорбции отвечает уравнению Лэнгмюра только в начальной стадии при малых степенях заполнения. Брунауэр, Эммет и Теллер разработали теорию полимолекулярной адсорбции (модель БЭТ). Были приняты те же допущения, что и в модели Лэнгмюра, но введено предположение об образовании второго и последующих слоев. Уравнение изотермы адсорбции БЭТ:
где v - объем адсорбированного газа; V - объем газа, необходимый для образования монослоя; p - измеряемое равновесное давление адсорбата; P0 -давление насыщенного пара адсорбата при температуре опыта; C - константа, зависящая от теплоты адсорбции и температуры опыта.
В эксперименте вместо v и V используют а ( равновесная величина адсорбции в мкмоль/г) и А (емкость монослоя в мкмоль/г).
Рис.4. Уравнение полимолекулярной физической адсорбции.
Уравнение (2) имеет вид:
Y = n + mX (3)
Рис. 5. Прямая, соответствующая линейной форме уравнения БЭТ.
Из наклона прямой и отрезка, отсекаемого ею на оси ординат, вычисляют С и А. По формуле (4) можно вычислить удельную поверхность образца адсорбента или катализатора:
S = kANS0 (4)
Где S - удельная площадь поверхности, м2/ г; A - емкость монослоя, мкмоль/ г; N - число Авогадро; S0 - площадь, приходящаяся на одну молекулу в монослое, нм2. Лекция 3.
Поиск по сайту: |


 = q,
= q,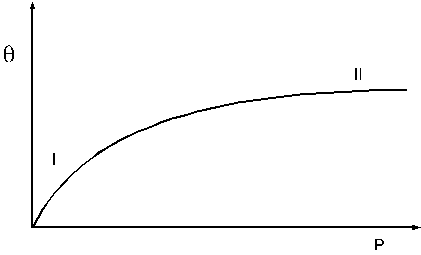
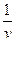
 (1)
(1)
 (2)
(2)