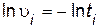|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Экспериментальная часть. Na2S2O3 + H2SO4 ® Na2SO4 + S¯ + Н2SO3⇐ ПредыдущаяСтр 11 из 11
Лабораторная работа
«Определение дифференциального кинетического уравнения» Зависимость скорости реакции от концентрации реагирующих веществ изучают на примере реакции взаимодействия серной кислоты H2SO4 и тиосульфата натрия Na2S2O3 Na2S2O3 + H2SO4 ® Na2SO4 + S¯ + Н2SO3. В результате этой реакции выделяется нерастворимое вещество – сера, поэтому о начальной скорости реакции можно судить по степени помутнения раствора. Одинаковое помутнение реакционной смеси в различных опытах указывает на то, что концентрация образовавшейся серы в этих опытах примерно одинакова. Проводя эту реакцию при различных начальных концентрациях одного из реагентов и постоянной концентрации другого реагента, можно определить величину пропорциональную скорости реакции. Для этого следует определить время t от начала реакции до едва заметного помутнения раствора. Степень помутнения раствора во всех опытах должна быть одинаковой. Если принять концентрацию выделившейся серы за единицу, то начальная скорость реакции будет обратно пропорциональна времени помутнения раствора
Дифференциальное кинетическое уравнение для изучаемой реакции выражается следующим образом:
Так как эта реакция протекает по сложному механизму, то порядки реакции по веществу отличаются от стехиометрических коэффициентов. Порядок реакции по серной кислоте n и порядок реакции по тиосульфату натрия m определяют, используя логарифмический вид дифференциального кинетического уравнения (пример 5)
При постоянной исходной концентрации серной кислоты оно будет иметь вид
Порядок реакции по тиосульфату натрия определяют как тангенс угла наклона прямой, построенной в координатах
Аналогично при постоянной исходной концентрации тиосульфата натрия определяют порядок реакции по серной кислоте - тангенс угла наклона прямой, построенной в координатах
Подставляя найденные значения порядков n и m в уравнение (7.1), вычисляют константу скорости реакции
Варианты работы
Выполнение работы
1. Налейте из бюретки в три пронумерованные пробирки раствор серной кислоты с концентрацией [H2SO4] = 0,2 моль/л в количестве ai мл (согласно варианту работы). 2. Налейте из бюретки в три пронумерованные колбы раствор тиосульфата натрия с концентрацией [Na2S2O3] = 0,1моль/л в количестве бi мл, и в эти же колбы налейте дистиллированной воды в количестве вi мл (согласно варианту работы). 3. По очереди, выполняя каждый опыт, перелейте содержимое пробирки с раствором H2SO4 в соответствующую номеру опыта колбу с раствором Na2S2O3. Взболтайте полученный раствор, и по секундомеру замерьте время t от момента сливания до момента появления первых признаков помутнения раствора. При этом отсчет времени следует продолжать до одинаковой мутности раствора. 4. Рассчитайте концентрации исходных веществ, находящихся в реакционной смеси, пользуясь формулами [H2SO4] = 0,2 [Na2S2O3] = 0,1 где 0,2 и 0,1 моль/л - исходные концентрации H2SO4 и Na2S2O3; ai, бi, вi – объем растворов (мл) H2SO4, Na2S2O3 и Н2О, взятых для опытов (индекс i означает номер опыта). 5. По полученным данным рассчитайте для каждого опыта значения ln 6. Постройте график зависимости ln
Таблица 7
7. Рассчитайте константу скорости для каждого опыта и найдите ее среднее значение. 8. Запишите дифференциальное кинетическое уравнение в явном виде, т.е. с числовыми значениями найденных порядков реакции и константы скорости. Ответьте на следующие вопросы. · Как зависит скорость химической реакции от концентрации реагирующих веществ? · В чем отличие между общим порядком реакции и порядком реакции по данному веществу? Для чего определяют порядок реакции? · В чем различие порядка и молекулярности реакции? Могут ли они быть равны? · В чем физический смысл константы скорости реакции? · От чего зависит константа скорости реакции?
Вопросы для самоконтроля 1. Что называют скоростью химической реакции? Какую размерность имеет скорость реакции? Дайте определение средней и истинной скорости. 2. Дайте определение простых и сложных реакций. Что такое молекулярность реакции? Что такое механизм химической реакции? 3. Как зависит скорость химической реакции от концентрации реагирующих веществ для элементарных реакций? Сформулируйте закон действующих масс. 4. Как зависит скорость химической реакции от концентрации реагирующих веществ для сложных реакций? Напишите дифференциальное кинетическое уравнение. Что называют порядком реакции? Как экспериментально определяют порядок реакции по данному веществу? 5. Как изменяются концентрации веществ во времени по мере прохождения реакции? Напишите интегральное кинетическое уравнение для реакции первого порядка. 6. От каких факторов зависит скорость химической реакции в гетерогенных системах? 7. Как и почему зависит скорость реакции от температуры? Напишите уравнение Аррениуса. Каков физический смысл констант уравнения? Какие экспериментальные данные необходимы для расчета энергии активации? 8. Объясните состояние химического равновесия с позиций химической термодинамики и химической кинетики. Дайте определения следующих понятий: обратимая химическая реакция; химическое равновесие; константа равновесия; равновесная концентрация вещества. 9. Как влияют изменения условий проведения химической реакции на состояние равновесия? Сформулируйте принцип Ле Шателье. Приведите примеры смещения химического равновесия. 10. Что называют катализатором? Какое влияние и почему оказывает катализатор на скорость химической реакции? Как влияет катализатор на состояние химического равновесия? 11. Дайте определение цепных реакций. Каков механизм цепных реакций?
Литература 1. Глинка Н.Л. Общая химия. – М.: Интеграл-Пресс, 2006. Гл.10, п.10.5 – 10.7. 2. Коровин Н.В. Общая химия. – М.: Высш. шк., 2007. Гл. 6, п. 6.3.
Оглавление
Болячевская Клавдия Ильинична, Литманович Андрей Аркадьевич, Остаева Галина Юрьевна, Панасенко Анатолий Александрович, Полякова Елена Владимировна.
ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ
Учебное пособие
Под общей редакцией проф. И.М. Паписова
Редактор Н.П. Лапина
Технический редактор Е.К. Евстратова
Тем. план 2007 г., п.70 ----------------------------------------------------------------------------------------------------------------Подписано в печать 2007 г. Формат 60х84/16 Печать офсетная Усл. печ. л. 5,2 Уч.-изд. л. 4,1 Тираж 1000 экз. Заказ Цена 35 руб. ------------------------------------------------------------------------------------------------------------------------------------- Ротапринт МАДИ (ГТУ), 125319, Москва, Ленинградский просп., 64
Поиск по сайту: |
 ,
, .
. .
. .
.
 .
.
 .
. 

 .
. .
. ;
; ,
,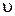 i , ln[H2SO4]i, ln[Na2S2O3]i. Данные опытов и вычислений запишите в табл. 7.
i , ln[H2SO4]i, ln[Na2S2O3]i. Данные опытов и вычислений запишите в табл. 7.