 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Применение уравнения Аррениуса
Энергию активации можно рассчитать по экспериментальным данным графическим или аналитическим способами, используя уравнение Аррениуса представив его в логарифмическом виде
Графический способ
Рис. 8. Зависимость константы скорости реакции от температуры По экспериментальным значениям константы скорости реакции при различных температурах строят график зависимости lnk = f ( По тангенсу угла наклона прямой к оси абсцисс вычисляют энергию активации
Аналитический способ Если предположить, что для выбранной реакции величины А и Еа постоянны в небольших пределах температур от Т1 до Т2, то уравнение Аррениуса (2.16) можно применить для двух различных температур (Т2> Т1; k (Т2) = k2; k (Т1) = k1)
В результате вычитания первого уравнения из второго получим
следовательно,
Под символом логарифма находится отношение констант скоростей реакции при двух температурах, поэтому константы можно заменить любыми пропорциональными им величинами при тех же температурах. Например, вместо констант скоростей можно подставить скорости реакции, если исходные концентрации реагирующих веществ при измерении скоростей в обоих опытах были одинаковы и скорость изменилась только под влиянием изменения температуры. Тогда получим следующие выражения:
Каталитические реакции Основные понятия
Катализаторы - вещества, изменяющие скорость реакции и остающиеся к концу реакции химически неизменными. Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции, протекающие под действием катализаторов, называются каталитическими реакциями. Реакции, в которых катализатором является продукт реакции, называются автокаталитическими. Важным свойством катализаторов является селективность (избирательность) их действия, проявляющаяся в увеличении скорости только определенной из нескольких возможных реакций. Вещества, малые примеси которых могут сильно снижать или полностью подавлять активность катализатора, называются каталитическими ядами. Промоторы – вещества, которые увеличивают активность катализаторов, хотя сами таковыми не являются. По фазовому принципу различают гомогенный и гетерогенный катализ.
Поиск по сайту: |
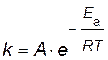 ,
,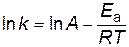 .
.

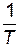 ) (рис. 8).
) (рис. 8). .
.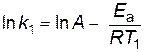 ;
;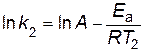 .
. ,
,
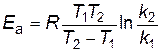 .
.
 ;
;
 .
.