 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Беседа по теме занятия. Государственного бюджетного образовательного учреждения высшего профессионального
КОМИ ФИЛИАЛ Государственного бюджетного образовательного учреждения высшего профессионального образования «КИРОВСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ» Министерства здравоохранения и социального развития Российской Федерации
Кафедра химии, физики, биологии Методические указания для студентов1 курса Специальности (направления подготовки) 060101 – Лечебное дело к практическому (лабораторному) занятию по дисциплине Химия ТЕМА: Скорость химической реакции. Катализ. Химическое равновесие. ЦЕЛЬ: Ознакомить с основами химической кинетики и химического равновесия.
ЗАДАЧИ: 1. Разобрать факторы, влияющие на скорость химической реакции (гомогенной и гетерогенной). 2. Научить рассчитывать скорость химических реакций. 3. Изучить на практике метод определения скорости химической реакции и влияние на ее скорость различных факторов. СТУДЕНТ ДОЛЖЕН ЗНАТЬ: 1. до изучения темы: Типы химических реакции, выражение скорости химических реакций. Понятия катализатор и ингибитор. Принцип Ле Шателье. 2. после изучения темы: Особенности протекания различных типов реакций. Описание протекания во времени химических и биохимических реакций с помощью кинетических уравнений, ферментативных процессов – с помощью уравнения Михаэлиса-Ментен. Описание положения равновесия обратимых реакций посредством константы химического равновесия и взаимосвязь константы с изменением энергии Гиббса для этих реакций.
СТУДЕНТ ДОЛЖЕН УМЕТЬ: Определять тип химической реакции: простая, сложная, гомогенная, гетерогенная, последовательная, параллельная, последовательно-параллельная, циклическая, цепная, необратимая и обратимая, ферментативная, сопряженная, колебательная. Записывать кинетическое уравнение для реакции. Производить измерение и расчет скорости реакции. СОДЕРЖАНИЕ ЗАНЯТИЯ: Вводный контроль. Проверка подготовленности к занятию через ответы на следующие вопросы: 1. Что называется скоростью химической реакции, в каких единицах она измеряется? Что 2. От каких факторов зависит скорость химической реакции? 3. Что называется константой скорости химической реакции? Ее физический смысл. От 4. Дать определение закона действующих масс. Напишите выражение закона действия масс для следующих реакций: 2 Н2 + О2 = 2 Н2О(пар) 2 SO2 + О2 = 2 SО3 2 СО = СО2 + С 2 ZnS + 3 О2 = 2 ZnO + 2 SO2 5. Во сколько раз следует увеличить концентрацию СО в системе 2СО = СО2 + С, чтобы 6. Во сколько раз надо изменить давление газовой смеси, чтобы скорость реакции 2SO2 + О2 7. Как зависит скорость химической реакции от температуры? Что показывает 8. На сколько градусов следует повысить температуру системы, чтобы скорость 9. Дать определение понятию "энергия активации". От каких факторов она зависит? Привести уравнение Аррениуса, связывающее ее с константой скорости. 10. Что такое катализатор? Почему введение катализатора в систему изменяет скорость 11. Какие реакции называются обратимыми? Каков физический смысл константы химического равновесия? От каких факторов она зависит? 12. Сформулировать общий принцип смещения равновесия (принцип Ле-Шателье). Определите, куда будет смещаться равновесие реакции N2 + ЗН2 <-> 2NH3 + 92 кДж, если: а) увеличить концентрацию азота; б) увеличить давление в газовой смеси; в) уменьшить объем; г) увеличить температуру.
Проверка подготовленности через тестирование по теме занятия. Примерные тестовые задания: 1. Величина ∆G0 при условии Кравн. = 1 равна 1) ∆G0 = 0 2) ∆G0 < 0 3) ∆G0 > 0 4) ∆G0 = 1 2. Равновесие реакции N2+3H2 →2NH3 + Q смещается 1) вправо при нагревании 2) влево при нагревании 3) вправо при понижении давления 4) влево при повышении давления 3. Условие, вызывающее смещение равновесия 2SO2 +O2 ↔ 2SO3 + Q в сторону обратной реакции (влево): 1) увеличение концентрации О2 2) нагревание 3) увеличение концентрации SO2 4) повышение давления 4. Закон, определяющий соотношение между равновесными концентрациями, называется: 1) законом сохранения масс 2) законом Рауля 3) законом действующих масс 4) законом Вант-Гоффа 5. Химическая кинетика изучает: 1) возможность протекания химических процессов 2) энергетические характеристики физических и химических процессов 3) скорости протекания химических превращения и механизмы этих превращений 4) тепловые эффекты биохимических процессов 6. Истинной (мгновенной) скоростью химической реакции называют: 1) количество вещества, прореагировавшего в единицу времени в единице объема 2) производную от концентрации реагирующего вещества по времени в единице объема 3) произведение концентраций реагирующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам в реакции 4) изменение концентрации вещества за единицу времени в единице объема 7. Средней скоростью химической реакции называют: 1) количество вещества, прореагировавшего в единицу времени в единице объема 2) производную от концентрации реагирующего вещества по времени в единице объема 3) произведение концентраций реагирующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам в реакции 4) изменение концентрации вещества за единицу времени в единице объема 8. Как изменяются скорости прямой и обратной реакции во время от начала реакции: 1) прямой – увеличивается, обратной - уменьшается 2) прямой – уменьшается, обратной - увеличивается 3) прямой и обратной - уменьшаются 4) прямой и обратной - увеличиваются 9. Для вычисления средней скорости гетерогенной реакции по изменению количества вещества (n) исходных веществ можно использовать уравнение:
10. Скорость химической реакции зависит от: 1) времени, температуры, концентрации 2) природы реагирующих веществ, температуры, концентрации 3) времени, температуры, концентрации, природы реагирующих веществ 4) температуры, концентрации 11. На скорость химической реакции влияют: а) природа реагирующих веществ; б) концентрация реагирующих веществ; в) катализатор; г) растворитель; д) температура 1) а, в, д 2) а, б, в, д 3) все факторы 4) б, в, д 12. Скорость измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности раздела фаз для реакций: 1) гомогенных 2) гетерогенных 3) протекающих в газовой фазе 4) протекающих в твердой фазе 13. Скорость измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема для реакции: 1) гомогенной 2) гетерогенной 3) на границе твердое тело-жидкость 4) на границе газ-жидкость 14. Единицы измерения скорости химической реакции: а) моль•л-1с-1; б) л•моль-1; в) с•моль-1; г) моль•л-1мин-1 1) а, г 2) а 3) б, в, г 4) а, в 15. Сформулируйте основной закон химической кинетики: 1) скорость сложной реакции, состоящей из ряда последовательных стадий, определяется скоростью самой медленной стадии 2) скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в уравнении реакции 3) скорость реакции определяется изменением числа реагирующих молекул в единицу времени в единице объема 4) скорость реакции увеличивается при увеличении температуры 16. Закон действующих масс устанавливает зависимость между скоростью химической реакции и: 1) температурой 2) массой реагирующих веществ 3) концентрацией реагирующих веществ 4) количеством реагирующих веществ 17. Величина константы скорости реакции зависит от: 1) времени реакции, температуры, катализатора 2) природы реакции, температуры, концентрации 3) природы реакции, температуры, катализатора 4)природы реакции и температуры 18. Численное значение константы скорости и скорости совпадают: 1) если концентрации реагирующих веществ постоянны и равны единице 2) если концентрации реагирующих веществ постоянны 3) если реагирующие вещества и продукты реакции находятся в одной фазе 4) никогда не совпадают 19. Приводит к изменению константы скорости реакции: а) изменение температуры; б) изменение объема реакционного сосуда; в) введение в систему катализатора; г) изменение концентрации реагирующих веществ 1) а, в 2) б, г 3) а, б, г 4) а, в, г 20. Скорость реакции определяется изменением концентрации реагирующих веществ в единицу времени: 1) если давление системы постоянно 2) если объем системы постоянен 3) если температура системы постоянна 4) если энергия системы постоянна 21. При изменение количества вещества А скорость не изменится для реакции: 1) А (г) + В (г) → 2) 2А (г) + В2 (г) → 3) 2А (т) + 2В (г) → 4) 3А (г) + В2 (т) → 22. Сумму показателей степеней при концентрациях, входящих в кинетическое уравнение называют: 1) общим кинетическим порядком реакции 2) молекулярностью реакции 3) порядком реакции по веществу 4) стехиометрическими коэффициентами 23. Порядком реакции по веществу называют: 1) показатель степени при концентрации, входящей в кинетическое уравнение 2) сумму показателей степеней при концентрациях, входящих в кинетическое уравнение 3) сумму стехиометрических коэффициентов реакции 4) стехиометрический коэффициент вещества 24. Реакции радиоактивного распада относятся к реакциям: 1) 1 порядка 2) 3 порядка 3) 2 порядка 4) 0 порядка 25. Молекулярностью реакции называется: 1) число молекул, вступающих в данную химическую реакцию 2) сумма стехиометрических коэффициентов реакции 3) число молекул, реагирующих в одном элементарном химическом акте 4) произведение стехиометрических коэффициентов 26. Порядок и молекулярность всегда совпадают: 1) для сложных реакций 2) для простых реакций, протекающих в одну стадию 3) никогда не совпадают 4) для многостадийных реакций 27. Химические реакции по механизму протекания подразделяются на: 1) простые и сложные 2) гомогенные и гетерогенные 3) экзотермические и эндотермические 4) обратимые и необратимые 28. Простой химической реакцией называют реакцию, если: 1) продукт образуется в результате непосредственного взаимодействия частиц реагентов 2) конечный продукт получается в результате осуществления двух и более простых реакций с образованием промежуточных продуктов 3) исходные и конечные вещества находятся в одной фазе 4) продукт образуется в результате взаимодействия двух и более частиц 29. Сложной химической реакцией называют реакцию, если: 1) продукт образуется в результате непосредственного взаимодействия частиц реагентов 2) конечный продукт получается в результате осуществления двух и более простых реакций с образованием промежуточных продуктов 3) исходные и конечные вещества находятся в одной фазе 4) продукт образуется в результате взаимодействия двух и более частиц 30. Лимитирующей стадией сложной химической реакции называют: 1) самую быструю стадию 2) самую сложную стадию 3) стадию, имеющую низкую энергию активации 4) самую медленную стадию 31. Сопряженными называют: 1) реакции, в которых продукт первой элементарной стадии вступает в реакцию второй стадии и т.д., пока не образуется конечный продукт 2) реакции, в которых одно и тоже вещество одновременно взаимодействует с одним или несколькими реагентами, участвуя в одновременно протекающих реакциях 3) реакции, из которых одна вызывает протекание в системе другой реакции, не осуществимой в отсутствии первой 4) реакции, в которых продукты реакции разлагаются с образованием исходных веществ 32. Параллельными (конкурирующими) называют: 1) реакции, в которых продукт первой элементарной стадии вступает в реакцию второй стадии и т.д., пока не образуется конечный продукт 2) реакции, в которых одно и тоже вещество одновременно взаимодействует с одним или несколькими реагентами, участвуя в одновременно протекающих реакциях 3) реакции, из которых одна вызывает протекание в системе другой реакции, не осуществимой в отсутствии первой 4) реакции, в которых продукты реакции разлагаются с образованием исходных веществ 33. Скорость параллельных реакций определяется: 1) скоростью самой медленной стадии 2) разностью скоростей всех стадий 3) суммой скоростей всех стадий 4) скоростью самой быстрой стадии 34. Реакции, в которых продукт первой элементарной стадии вступает в реакцию второй стадии и т.д., пока не образуется конечный продукт, называются 1) параллельными 2) последовательными 3) сопряженными 4) конкурирующими 35. Реакции, в которых одно и тоже вещество одновременно взаимодействует с одним или несколькими реагентами, участвуя в одновременно протекающих реакциях, называются: 1) параллельными 2) последовательными 3) сопряженными 4) конкурирующими 36. С ростом температуры увеличивается скорость реакций: 1) экзотермических 2) экзо- и эндотермических 3) эндотермических 4) обратимых 37. Реакции гидролиза белков относятся к типу: 1) последовательных 2) параллельных 3) сопряженных 4) простых 38. Правило Вант-Гоффа формулируется: 1) при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза 2) для большинства химических реакций скорость реакции увеличивается с ростом температуры 3) при понижении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза 4) скорость реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам реакции 39. При повышении температуры на каждые 10 градусов скорость большинства реакций: 1) увеличивается в 2-4 раза 2) не изменяется 3) уменьшается в 2-4 раза 4) увеличивается в 4-5 раз 40. Укажите возможные значения температурного коэффициента скорости реакций, протекающих в живых организмах: 1) 2-4 2) 7-9 3) больше 9 4) меньше 2 41. Увеличение скорости реакции с повышением температуры вызывается главным образом: 1) возрастанием числа активных молекул 2) ростом числа столкновений 3) увеличением средней кинетической энергии молекул 4) уменьшением энергии активации реакции 42. Повышение скорости реакции при введении катализатора объясняется: а) уменьшением энергии активации; б) увеличением средней кинетической энергии молекул; в) возрастанием числа столкновений; г) ростом числа активных молекул: 1) а, г 2) а, в, г 3) все 4) б, в, г 43. Действие катализатора на скорость химической реакции объясняется: 1) возникновением активированных комплексов 2) увеличением числа столкновений 3) возникновением активированных комплексов и изменением энергии активации 4) изменением энергии активации 44. Ускоряющее действие катализаторов обусловлено: 1) существенным уменьшением энергии активации соответствующего превращения 2) существенным увеличением энергии активации соответствующего превращения 3) образованием активированного комплекса 4) существенным увеличением числа столкновений 45. Действие ферментов: а) изменяет тепловой эффект реакции; б) снижает энергию активации; в) увеличивает скорость прямой и обратной реакции; г) является избирательным 1) все 2) б, в, г 3) б, г 4) а, б, г 46. Действие катализаторов: а) изменяет тепловой эффект реакции; б) снижает энергию активации; в) увеличивает скорость прямой и обратной реакции; г) является избирательным 1) все 2) б, в, г 3) б, г 4) б, в 47. При действии ферментов: а) снижается энергия активации; б) увеличивается скорость прямой и обратной реакции; в) изменяется тепловой эффект реакции; г) увеличивается скорость только прямой реакции 1) а, б, в 2) а, б 3) б, в 4) а, г 48. Повышение скорости биохимической реакции при введении в систему фермента объясняется: а) уменьшением энергии активации; б) увеличением средней кинетической энергии молекул; в) ростом числа активных молекул; г) уменьшением числа столкновений молекул 1) а, в 2) все 3) б, в 4) а, в, г 49. Мономолекулярной реакцией является: 1) 2SO2 + O2 → 2SO2 2) H2 + Br2 →2HBr 3) 2HI → H2 + I2 4) MgCO3 → MgO + CO2 50. Бимолекулярной реакцией является: 1) 2NO + O2 → 2NO 3) CaCO3 → CaO + CO2 2) SO2 + CI2 → SO2 4) N2 + 3H2 → 2NH3 51. Тримолекулярной реакцией является: 1) C2H4 + H2 → C2H6 3) CO + 2H2 → 2NH3 2) C + H2O → CO + H2 4) F2 + H2 → 2HF 52. Реакция H2 + I2 → 2HI является: 1) мономолекулярной 3) тримолекулярной 2) бимолекулярной 4) первого порядка 53. Реакция C4H10 → C2H6 + C2H4 является: 1) мономолекулярной 3) тримолекулярной 2) бимолекулярной 4) первого порядка 54. Реакция гидролиза крахмала крахмал →декстраны →мальтоза →глюкоза является: 1) сопряженной 3) параллельной 2) цепной 4) последовательной 55. Реакция образования оксигемоглобина Hb + O2 → HbO2 имеет общий порядок, равный: 1) 0 2) 0,5 3) 1 4) 2 56. Типы сложных реакций, к которым относится пероксидное окисление липидов: 1) сопряженные 3) параллельные 2) цепные 4) последовательные 57. Типы сложных реакций в организме с участием АТФ: 1) сопряженные 3) параллельные 2) цепные 4) последовательные 58. Фотохимической реакцией является 1) синтез АТФ 3) аэробное окисление глюкозы 2) образование озона 4) гидролиз АТФ 59. Общая схема ферментативного анализа: 1) S + E → P → E 3) S + E → SE → E + P 2) S → PS → P + S 4) P + E → PE → E + S 60. Кинетическим уравнением бимолекулярной реакции является: 1) υ = ķ · С1 · С2 2) υ = ķ · С1² · С2 3) υ = ķ · С1 · С2² 4) υ = 61. Кинетическим уравнением мономолекулярной реакции является: 1) υ = ķ · С1 · С2 2) υ = ķ · С 3) υ = ķ · С1 · С2² 4) υ = ķ 62. Уравнение Аррениуса: 1) 63. Уравнение Вант – Гоффа: 1) 64. Уравнения Михаэлиса–Ментен показывает зависимость скорости ферментативной реакции от: 1) давления 3) концентрации 2) температуры 4) присутствия катализаторов 65. Уравнение Михаэлиса–Ментен: 1) υ max = 66. При увеличении концентрации реагента в 3 раза скорость реакции I порядка: 1) уменьшается в 3 раза 3) увеличивается в 3 раза 2) увеличивается в 9 раз 4) уменьшается в 9 раз 67. При увеличении концентрации реагентов в 2 раза скорость реакции II порядка: 1) увеличивается в 2 раза 3) уменьшается в 4 раза 2) увеличивается в 4 раза 4) уменьшается в 2 раза 68. Уравнение Вант-Гоффа показывает зависимость скорости реакции от: 1) давления 3) концентрации 2) температуры 4) размеров реагирующих веществ 69. Температурный коэффициент в уравнении Вант – Гоффа может меняться в: 1) 1 – 2 раза 3) 2 – 6 раз 2) 2 – 4 раза 4) 2 – 8 раз 70. При повышении температуры на 30оС скорость реакции с температурным коэффициентом γ = 2: 1) увеличится в 5,48 раз 3) увеличится в 8 раз 2) увеличится в 6 раз 4) уменьшится в 15 раз
Беседа по теме занятия. Общие принципы химической кинетики применимы и к биохимическим ферментативным реакциям. Понятие о скорости реакции и о влиянии на нее различных факторов (концентрации реагирующих веществ, температуры, рН среды, катализаторов) необходимо врачу, поскольку на скорость биохимических реакций оказывают влияние лекарственные препараты, от скорости ферментативных реакций зависит интенсивность обмена веществ в организме и т.д. Классификация химических реакций, факторы, влияющие на скорость как гомогенной, так и гетерогенной реакции. Особенности кинетики гетерогенных и цепных реакций. Химическое равновесие и условия его смещения. Ферментативный катализ и его особенности.
Практическая работа 1) Выполнить лабораторную работу ««Изучение кинетики реакции разложения тиосульфата натрия в кислой среде».
2) Цель работы: Определить скорость разложения тиосульфата натрия в кислой среде. Определить порядок реакции по реагентам, вывести кинетическое уравнение и предложить возможный механизм реакции. Рассчитать константу скорости реакции. Изучить влияние температуры на скорость реакции.
3) Методика проведения работы. Реакция разложения тисульфата натрия в кислой среде протекает по уравнению: Na2S2O3 (p) + H2SO4 (p) → S(т)↓ + SO2 (г) + Na2SO4 (p) + H2O (ж) Скорость образования осадка серы может быть определена по промежутку времени от начала сливания растворов до образования видимой молочно-голубой опалесценции, появление которой связано с переходом гомогенной системы в гетерогенную.
Опыт 1. Исследование влияния концентрации тиосульфата натрия на скорость его разложения в кислой среде. Концентрация серной кислоты остается постоянной. Изменяется только концентрация Na2S2O3. а) Заполните 5 пробирок первого ряда раствором тиосульфата натрия и водой в соответствии с таблицей 1, чтобы суммарный объем был равен 8 мл. б) Заполните 5 пробирок второго ряда раствором серной кислоты согласно таблице 1. в) Влейте раствор Na2S2O3 из первой пробирки в пробирку с серной кислотой, отметьте время начала сливания растворов (t0). г) Продолжайте отчет времени до появления молочно-голубой опалесценции (t к). Время реакции образования серы: ∆t = t к - t 0, выразите в секундах и занесите в таблицу 1. д) Рассчитайте концентрацию реагентов в реакционной системе с учетом разбавления:
где С0 и V0 - исходный концентрации и объемы растворов тиосульфата и серной кислоты, взятые для опыта; V р-ра – суммарный объем раствора. Данные запишите в таблицу 1. е) Значение скорости реакции пропорционально величине 1/∆t. Вычислите эту величину. ж) Аналогичные эксперименты проведите с другими приготовленными растворами. Результаты экспериментов и расчетов занесите в таблицу 1.
Опыт 2. Исследование влияния концентрации серной кислоты на скорость разложения тиосульфата натрия. Концентрация Na2S2O3 остается постоянной, а меняется концентрация серной кислоты. а) Заполните два ряда по 5 пробирок согласно таблице 2. б) Растворы серной кислоты добавьте к растворам тиосульфата натрия. Заметьте время начала реакции и время появления молочно-голубой опалесценции, аналогично опыту 1. в) Результаты наблюдений и вычислений занесите в таблицу 2.
Опыт 3. Исследование влияния температуры на скорость химической реакции разложения тиосульфата натрия в кислой среде. а) Заполните 3 пробирки первого ряда раствором тиосуьфата натрия и водой, а 3 пробирки второго ряда – раствором серной кислоты, согласно таблице 1 пробирка №5. б) При комнатной температуре реакцию проводите путем быстрого приливания раствора тиосульфата к серной кислоте. Отметьте время начала сливания растворов t 0. в) Конец реакции t к определяют по появлению молочно-голубоватой опалесценции раствора. Время реакции ∆t = t к - t 0 занесите в таблицу 3. г) Проведите такие же опыты при температурах на 100 и 200С выше комнатной. Для этого надо каждую пару пробирок с солью и кислотой предварительно выдержать около 5 минут в стакане с водой требуемой температуры. Воду в стакане можно подогреть путем добавления горячей воды. д) Не вынимая пробирку с серной кислотой из воды, быстро влить в нее раствор тиосульфата, отметить время начала опыта и время появления опалесценции. Результаты внести в таблицу 3.
4) Результаты представить в виде заполненных таблиц: Таблица 1.
Таблица 2.
Таблица 3.
5) В выводе отметьте, что изучено в работе. Постройте графики зависимости скорости реакции от: - концентрации тиосульфата натрия, - концентрации серной кислоты; - температуры. На основании графиков определите порядок реакции разложения тиосульфата по каждому реагенту. Напишите полное кинетическое уравнение исследуемой реакции. Вычислите значение константы скорости данной реакции (по графику зависимости скорости от концентрации соли), как тангенс угла наклона прямой к оси абсцисс. Как согласуется рассчитанный температурный коэффициент с правилом Вант-Гоффа. Почему повышение температуры увеличивает скорость реакции. 4. Задачи для самостоятельного разбора на занятии: Выполнить упражнения: 1. В процессе газового разложения NO2 по уравнению 2 NO2 = 2 NO + O2 концентрация NO2 в начальный момент времени была 0,01 моль/л, а через 120 секунд она стала равной 0,0016 моль/л. Найдите среднюю скорость реакции. Изобразите кинетические кривые для NO2 и O2.
2. Вычислите истинную скорость простой реакции: CH3COOC2H5 + NaOH → CH3COONa + C2H5OH, если константа скорости реакции равна 5.4 л/моль•с, а концентрации реагирующих веществ соответственно равны: С(CH3COOC2H5) = 0,2 моль/л, С(NaOH) = 0,4 моль/л.
3. Найдите начальную скорость реакции: H2O2 + 2 HI → I2 + 2 H2O, если смешали равные объемы раствора перекиси с концентрацией 0,02 моль/л и раствора HI с концентрацией 0,05 моль/л, константа скорости равна 0,05 л/моль•с.
4. Во сколько раз изменится скорость реакции 2 SO2 (г) + O2 (г) = 2 SO3 (г), если: а) увеличить концентрацию кислорода в 2 раза; б) увеличить концентрацию SO2 в 2 раза; в) одновременно увеличить концентрацию кислорода и SO2 в 2 раза.
5. Во сколько раз изменится (уменьшится или увеличится) скорость химической реакции при изменении температуры от 700 до 200С, если температурный коэффициент равен 2?
6. Термическое разложение ацетальдегида проходит по уравнению: CH3CHO (г) → CH4 (г) + CO (г) При некоторой температуре получены следующие данные по зависимости скорости разложения от концентрации альдегида:
а) Постройте график зависимости n = f (C), б) Определите порядок реакции по альдегиду графически, в) Напишите экспериментальное кинетическое уравнение, г) Вычислите константу скорости реакции при данной температуре, д) Вычислите скорость разложения при начальной концентрации альдегида 0,3 моль/л.
7. В какую сторону сместится равновесие при: а) увеличении давления; б) увеличении объема системы; в) повышения температуры в следующих обратимых реакциях: 2 SO2 + O2 ↔ 2 SO3 ∆Н = - 196 кДж H2 + Br2 ↔ 2 HBr ∆Н = - 73.2 кДж 2 N2 + O2 ↔ 2 N2O ∆Н = + 163 кДж
Рекомендуемая литература: Основная: 1. В.А. Попков, С.А. Пузаков. Общая химия: Учебник. - М.: ГЭОТАР-Медиа. - 2010. 2. С.А. Пузаков, В.А. Попков. Сборник задач и упражнений по общей химии. - М.: Высшая школа. – 2004.
Дополнительная: 1. В.И. Слесарев. Основы химии живого.- Санкт-Петербург: Химиздат.- 2001. 2. А.В. Суворов, А.Б. Никольский. Вопросы и задачи по общей химии. – Санкт-Петербург: Химиздат. – 2002.
Методические указания подготовлены: доцентами Н.И. Никитиной и Е.И. Казаковой
Методические указания утверждены на заседании кафедры №_____ от «___» ________20___ г.
Зав. кафедрой: _____________________________/Е.И. Казакова
Поиск по сайту: |
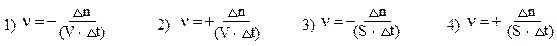
 · С1 · С2
· С1 · С2 2) k1 = k2 · γ
2) k1 = k2 · γ 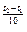
 3)
3) 
 2) υcm =
2) υcm = 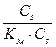
 3) υcm =
3) υcm = 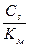 4) υ max = =
4) υ max = = 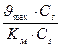
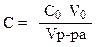 ,
,