 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
I. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
1.1 ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ Химическая кинетика – раздел физической химии, изучающий скорости протекания химических реакций, их механизм и факторы, влияющие на скорость реакций. Скорость химической реакции определяется изменением количества одного из реагентов или продуктов реакции в единицу времени в единице реакционного пространства. Отсюда скорость реакции
где Учитывая, что молярная концентрация вещества
то изменение молярной концентрации
и ,соответственно, получаем среднюю скорость реакции за промежуток времени
где знак (+) относится к изменению концентрации продуктов реакции, знак (-) – к изменению концентрации реагентов. В уравнении химической реакции:
В ходе реакции концентрации веществ все время меняются, поэтому в химической кинетике рассматривают истинную, или мгновенную скорость реакции (в данный момент времени) и выражают ее первой производной концентрации вещества по времени:
Скорость химической реакции зависит от многих факторов: от природы реагирующих веществ, концентрации, температуры, присутствия катализаторов, давления (в реакциях с участием газов). Под природой реагирующих веществ понимают реакционную способность этих веществ, которая, так же как физические и химические свойства веществ, зависит от их состава, строения и внутримолекулярных связей.
1.2 ЗАКОН ДЕЙСТВУЮЩИХ МАСС Влияние концентрации веществ на скорость реакции определяется законом действующих масс: при постоянной температуре скорость гомогенной химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в уравнении реакции. Закон действующих масс для прямой гомогенной реакции,
протекающей слева направо в однородной среде (смесь газов, раствор) (
Для гетерогенной реакции, протекающей на границе раздела фаз (твердой и жидкой, твердой и газообразной) концентрации веществ, находящихся в конденсированном состоянии, постоянны и включаются в константу скорости реакции. Тогда для прямой реакции
если вещество
Для обратимых химических реакций, которые могут протекать как в прямом, так и в обратном направлениях, скорости реакции (5) запишутся: Таблица 1
Константа скорости реакции зависит от природы реагирующих веществ, температуры и присутствия катализатора. Для каждой реакции при постоянной температуре константа скорости величина постоянная. Используя закон действующих масс, можно определить, как будет изменяться скорость реакции при изменении параметров системы:
Пример 1. Для гомогенной газофазной реакции
определить: а) во сколько раз изменится скорость прямой реакции, если концентрацию азота уменьшить в 2 раза, а концентрацию водорода увеличить в 2 раза; б) давление в системе увеличить в 3 раза. Решение. а) Согласно закону действующих масс, скорость прямой химической реакции описывается уравнением
После изменения концентрации реагентов будут равны
Изменение скорости прямой реакции по отношению к первоначальной:
т. е. скорость прямой реакции увеличится в 4 раза. б) Из уравнения состояния газов (уравнение Менделеева-Клапейрона)
следует с учетом (2):
что Следовательно, увеличение (или уменьшение) давления в системе в Тогда по условию задачи при увеличении давления в 3 раза новые концентрации веществ (
тогда
откуда: т. е. скорость прямой реакции увеличится в 81 раз.
Пример 2. Для реакции Решение. а) Прямая реакция гетерогенная, концентрация твердого углерода не входит в выражение скорости реакции, поэтому:
или, учитывая:
получаем:
Обозначим новый объем
и По условию задачи
Следовательно, объем системы увеличился в 2 раза ( б) Поскольку молярная концентрация вещества обратно пропорциональна объему системы (уравнение 2), то при увеличении объема в Если объем системы увеличился в 2 раза, то для обратной гомогенной реакции закон действующих масс запишется: до изменения объема:
после увеличения объема в 2 раза:
И тогда отношение скоростей будет равно:
Таким образом, скорость обратной реакции уменьшилась в 8 раз.
1.3 ИЗМЕНЕНИЕ КОНЦЕНТРАЦИЙ ВЕЩЕСТВ И СКОРОСТЕЙ В ХОДЕ РЕАКЦИИ В ходе гомогенной реакции
концентрации реагентов
Как правило, в начальный момент времени концентрации продуктов реакции Изменения концентраций
В соответствии с вышеизложенным различают скорости реакции:
Таблица 2
Используя уравнения (13 – 15) и таблицу 2, можно рассчитать концентрации и скорости реакций в любой момент времени.
Пример 3. Начальные концентрации реагентов газофазной реакции
равны (моль/л): Решение. Для ответа на поставленные в задаче вопросы необходимо рассчитать:
с0, сτ иΔс связаны между собой соотношениями:
а т.к то Задача сводится в основном к определению изменения концентраций веществ, участвующих в реакции. Для наглядности внесем исходные данные в таблицу. Таблица 3
По мере определения указанных в таблице величин будем вносить их значения в таблицу. Значения обозначаем *. или: По условию задачи прореагировало 20% с0(CS2) = 0,2 моль/л – 100% Δс(CS2) – 20%, откуда
Находим
откуда:
Вычисляем концентрации реагентов и продуктов в момент времени Реагенты:
Продукты:
Ниже представлен окончательный вариант таблицы 3 с результатами расчетов.
Таблица 4
а) Вычисляем, во сколько раз изменится скорость прямой реакции в момент времени
Итак, скорость прямой реакции уменьшится в 19,53 раза. б) Рассчитаем скорость обратной реакции
Пример 4. Начальная концентрация оксида азота (I) в реакции
составляет 0,7 моль/л, константа скорости прямой реакции Решение. Для решения задачи необходимо: а) рассчитать скорость прямой гетерогенной реакции в момент
По условию задачи
Тогда, пользуясь соотношением (15), запишем:
определяем: а)
Результаты расчетов представим в виде таблицы 5. Таблица 5
б) скорость прямой реакции в момент времени τ:
в) массовая доля прореагировавшего N2O:
Пример 5. Константа скорости гомогенной реакции
равна Решение. Известна концентрация одного из продуктов реакции –
Тогда, пользуясь соотношением (15)
определяем:
Искомая концентрация
Находим начальные концентрации реагентов. Поскольку
О втором реагенте ( С0(HI) – 100% Δc(HI) = 0,4 моль/л – 80% откуда
Начальную скорость прямой реакции рассчитываем по закону действующих масс:
Результаты расчетов представим в виде таблицы 6. Таблица 6
Пример 6. В результате протекания реакции
в реакционном сосуде объемом 5 л к некоторому моменту времени образовалось 71 г Решение. Вычислим концентрацию продуктов реакции:
Поскольку
Тогда, пользуясь соотношением (15) записываем:
определяем:
Искомая концентрация кислорода в момент времени
Находим начальные концентрации реагентов. Для этого сначала определяем концентрацию воды в момент времени
Поскольку
По условию задачи, хлора прореагировало в 2 раза больше, чем осталось:
откуда концентрация хлора в момент времени
Учитывая, что
скорость прямой реакции в момент времени
Результаты расчетов представим в виде таблицы 7.
Таблица 7
1.4 ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ 1.4.1 Правило Вант-Гоффа С повышением температуры скорость реакции увеличивается. Зависимость скорости реакции от температуры приближенно описывается эмпирическим правилом Вант-Гоффа: при повышении температуры на каждые 10° скорость реакции увеличивается в 2-4 раза. Математическое выражение правила Вант-Гоффа:
а при условии, что концентрации всех реагирующих веществ равны 1 моль/л:
где Температура может быть выражена как в °С, так и в К, так как изменение температуры не зависит от единиц измерения (
Поскольку при концентрациях реагирующих веществ 1 моль/л скорость химической реакции численно равна константе скорости
Учитывая тот факт, что скорость реакции обратно пропорциональна времени ее протекания из уравнения (18), при
Используя уравнения (16 – 20), можно рассчитать: - константу скорости (или скорость) реакции при заданной температуре, если известны значения этих величин при двух других температурах; - на сколько градусов надо повысить (или понизить) температуру реакции, чтобы скорость ее увеличилась (или уменьшилась) в N раз; - при какой температуре следует проводить реакцию, чтобы она закончилась за определенное время, если известны температурный коэффициент реакции и скорость ее при любой температуре; - температурный коэффициент реакции и т. д.
Пример 7. Рассчитайте константу скорости химической реакции при Решение а). Для определения
Учитывая:
б). Температурный коэффициент
в) а)
или б) Ответ:
Пример 8. На сколько градусов надо повысить температуру реакции, чтобы скорость ее увеличилась в 15 раз, если Решение. Из математического выражения правила Вант-Гоффа (16) и условия задачи получаем:
Логарифмируя уравнение (22), получаем формулу для определения
Подставляя в (23) условия задачи, получаем:
Ответ: Температуру реакции надо повысить на 7,78 °. Примечание: Если известна температура (
Пример 9. Сколько времени потребуется для проведения реакции при температуре 348 °К, если при температуре 298 °К она заканчивается за 30 минут; Решение 1. Из правила Вант-Гоффа (16) следует:
2. Поскольку скорость реакции обратно пропорциональна времени (1, 4), то
3. Из (24), (25) получаем:
Таким образом, при 1.4.2. Уравнение Аррениуса Более точно зависимость константы скорости реакции от температуры описывается уравнением Аррениуса:
Если при изменении температуры концентрация реагентов остается постоянной, то зависимость скорости реакции от температуры описывается уравнением:
Энергия активации – это минимальная дополнительная или избыточная энергия по сравнению со средней энергией реагирующих частиц, которой должны обладать соударяющиеся частицы, чтобы вступить в реакцию. Частицы, обладающие такой энергией, называются активными. Энергия активации процесса зависит от природы реагирующих веществ. Значения энергии активации для химических реакций могут составлять от 40 до 200 кДж/моль. По гипотезе Аррениуса химическое взаимодействие осуществляется только при соударении активных частиц, доля которых в системе пропорциональна величине Используя уравнение Аррениуса можно рассчитать: - - константу скорости реакции при заданной температуре, если известны энергия активации реакции и константа скорости при какой-либо температуре. Скорости при нескольких температурах можно рассчитать двумя способами.
Пример 10. Рассчитайте энергию активации процесса, если известно:
Решение.
Откуда:
Прологарифмировав последнее уравнение, с учетом того, что
и, соответственно:
Для 726 К и 746 К:
Для 726 К и 766 К:
Для 746 К и 766 К:
Средняя энергия активации равна
Пример 11. Рассчитайте
Решение.
Для этого представим экспериментальные данные в следующем виде:
На их основе строим график зависимости Из рис.1, согласно уравнению (26)
Из уравнения (24) следует:
Продлив график до пересечения с осью
Таким образом:
Приложение 1
Поиск по сайту: |
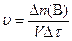 , (1)
, (1) – изменение количества вещества
– изменение количества вещества  , моль, за промежуток времени реакции
, моль, за промежуток времени реакции  , с-1;
, с-1;  – объем системы, л.
– объем системы, л. моль/л, (2)
моль/л, (2) , моль/л;, (3)
, моль/л;, (3)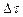 :
: , (4)
, (4) (5)
(5) ,
,  ,
,  – продукты – вещества, образующиеся в результате реакции;
– продукты – вещества, образующиеся в результате реакции; ,
,  ,
, 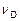 ,
,  – стехиометрические коэффициенты, показывающие, какое количество соответствующего вещества участвует в реакции.
– стехиометрические коэффициенты, показывающие, какое количество соответствующего вещества участвует в реакции. (6)
(6) (7)
(7)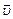 ), имеет вид:
), имеет вид: (8)
(8) , (9)
, (9) (10)
(10) )
)

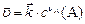

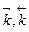 – константы скоростей прямой и обратной реакций, соответственно. Физический смысл константы скорости: при концентрации всех реагирующих веществ, равных 1 моль/л, константа скорости равна скорости реакции.
– константы скоростей прямой и обратной реакций, соответственно. Физический смысл константы скорости: при концентрации всех реагирующих веществ, равных 1 моль/л, константа скорости равна скорости реакции. ,
, 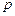 ,
, 
 .
. ;
;  , тогда
, тогда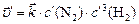 , или
, или .
. ,
, (11)
(11) , (12)
, (12) ) прямо пропорционально молярной концентрации газообразных веществ.
) прямо пропорционально молярной концентрации газообразных веществ. раз приводит соответственно к увеличению (или уменьшению) концентрации всех газов-участников реакции также в
раз приводит соответственно к увеличению (или уменьшению) концентрации всех газов-участников реакции также в  ):
): ;
;  ,
, или
или ,
, ,
,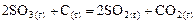 определите: а) как был изменен объем системы, если скорость прямой реакции уменьшилась в 4 раза? б) во сколько раз при этом изменилась скорость обратной реакции?
определите: а) как был изменен объем системы, если скорость прямой реакции уменьшилась в 4 раза? б) во сколько раз при этом изменилась скорость обратной реакции? ,
, ,
, .
. ; так как количество
; так как количество  в системе не меняется, то
в системе не меняется, то ,
,
 , откуда
, откуда ;
; или
или  , т. е.
, т. е.  .
. ).
). ;
;
 .
.

 и в некоторый момент времени
и в некоторый момент времени  равны:
равны: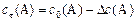



 ).
). для каждого вещества-участника реакции связаны со стехиометрическими коэффициентами в уравнении реакции:
для каждого вещества-участника реакции связаны со стехиометрическими коэффициентами в уравнении реакции: (15)
(15) – начальную и
– начальную и  – в любой момент времени.
– в любой момент времени.

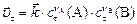


 ;
;  . Рассчитать: а) во сколько раз по сравнению с первоначальной изменится скорость прямой реакции в тот момент, когда прореагирует 20% сероуглерода. б) скорость обратной реакции в этот момент времени, если
. Рассчитать: а) во сколько раз по сравнению с первоначальной изменится скорость прямой реакции в тот момент, когда прореагирует 20% сероуглерода. б) скорость обратной реакции в этот момент времени, если  моль-2·л2·с-1.
моль-2·л2·с-1.




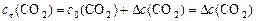 ,
,
 ,
, .
.





 , моль
, моль
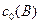 , моль/л
, моль/л
 , моль/л
, моль/л
 , моль/л
, моль/л

 . Чтобы определить
. Чтобы определить 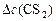 , составляем пропорцию:
, составляем пропорцию: моль/л.
моль/л. ,
, моль/л;
моль/л; моль/л;
моль/л; моль/л.
моль/л. моль/л.
моль/л. моль/л.
моль/л. моль/л.
моль/л. моль/л.
моль/л. , моль/л
, моль/л
 , моль/л
, моль/л
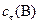 , моль/л
, моль/л



 .
.

 .
.
 . Определить скорость прямой реакции в тот момент времени, когда образовалось 0,3 моль/л диоксида углерода; массовую долю прореагировавшего оксида азота (I), а также концентрацию образовавшегося азота в этот момент.
. Определить скорость прямой реакции в тот момент времени, когда образовалось 0,3 моль/л диоксида углерода; массовую долю прореагировавшего оксида азота (I), а также концентрацию образовавшегося азота в этот момент.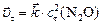 ; б) концентрацию продукта реакции (
; б) концентрацию продукта реакции (  ) в момент
) в момент  ; в) массовую долю прореагировавшего диоксида углерода (
; в) массовую долю прореагировавшего диоксида углерода (  ).
).
 моль/л;
моль/л; моль/л.
моль/л. ,
, моль/л;
моль/л;
 моль/л;
моль/л;  моль/л;
моль/л;  моль/л.
моль/л.


 .
.
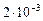 . Через некоторое время от начала реакции в реакционной смеси обнаружено 20 % от первоначального количества HJ, 0,2 моль/л
. Через некоторое время от начала реакции в реакционной смеси обнаружено 20 % от первоначального количества HJ, 0,2 моль/л  и 0,4 моль/л
и 0,4 моль/л  . Рассчитать концентрацию
. Рассчитать концентрацию 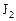 в этот момент и начальную скорость прямой реакции.
в этот момент и начальную скорость прямой реакции. , что позволяет вычислить изменение концентрации
, что позволяет вычислить изменение концентрации  к моменту времени
к моменту времени  моль/л;
моль/л; моль/л.
моль/л. ,
, (моль/л);
(моль/л);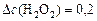 (моль/л);
(моль/л); (моль/л).
(моль/л). моль/л;
моль/л; , то
, то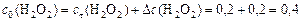 моль/л.
моль/л. ) известно, что в реакционной смеси обнаружено (
) известно, что в реакционной смеси обнаружено (  ) 20 % от первоначального количества; значит, прореагировало (
) 20 % от первоначального количества; значит, прореагировало ( 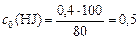 (моль/л).
(моль/л).





 , осталось 0,4 моль
, осталось 0,4 моль  .
. моль/л.
моль/л.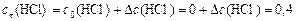 моль/л,
моль/л, моль/л.
моль/л.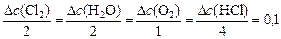 ,
, моль/л;
моль/л; моль/л;
моль/л; моль/л.
моль/л. моль/л.
моль/л. моль/л,
моль/л, , то начальная концентрация воды
, то начальная концентрация воды моль/л.
моль/л.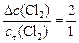 ,
,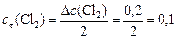 моль/л.
моль/л. , определяем начальную концентрацию хлора:
, определяем начальную концентрацию хлора: моль/л. Рассчитываем скорость прямой реакции в начальный момент времени:
моль/л. Рассчитываем скорость прямой реакции в начальный момент времени:







 (16),
(16), (17),
(17), ,
,  и
и 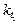 ,
,  - соответственно скорости и константы скоростей реакции при температурах
- соответственно скорости и константы скоростей реакции при температурах  и
и  .
. ).
). - температурный коэффициент скорости реакции, который показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10 градусов:
- температурный коэффициент скорости реакции, который показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10 градусов: (18)
(18) , то
, то (19)
(19) получаем
получаем (20)
(20) °С, если константа скорости этой реакции при температурах 400 °С и 500 °С равна соответственно 0,03 и 50,3.
°С, если константа скорости этой реакции при температурах 400 °С и 500 °С равна соответственно 0,03 и 50,3. запишем уравнение Вант-Гоффа (17), используя
запишем уравнение Вант-Гоффа (17), используя  или
или 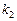 :
: или
или 
 ,
,  , получаем:
, получаем: или
или  (21)
(21) , полученного из уравнения (17):
, полученного из уравнения (17):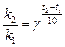





 .
.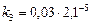


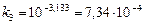

 при
при  .
. , откуда
, откуда (22)
(22)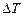 :
:
 (23)
(23) °
°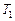 ), при которой проводилась реакция ранее, то используя полученные данные, можно рассчитать температуру (
), при которой проводилась реакция ранее, то используя полученные данные, можно рассчитать температуру (  ), при которой следует проводить реакцию, чтобы скорость ее увеличилась в N раз:
), при которой следует проводить реакцию, чтобы скорость ее увеличилась в N раз: .
. .
.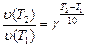 (24)
(24) (25)
(25)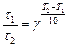 ,
, 

 К реакция закончится за 0,94мин.
К реакция закончится за 0,94мин.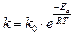 , (26)
, (26) , где (27)
, где (27)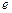 - основание натурального логарифма;
- основание натурального логарифма; - энергия активации реакции, Дж/моль;
- энергия активации реакции, Дж/моль; - универсальная газовая постоянная,
- универсальная газовая постоянная,  Дж/моль·К;
Дж/моль·К; - температура, К;
- температура, К; - предэкспоненциальный множитель;
- предэкспоненциальный множитель; при
при 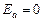 .
. . С увеличением температуры доля этих частиц в системе растет и соответственно растет скорость реакции.
. С увеличением температуры доля этих частиц в системе растет и соответственно растет скорость реакции.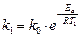 и
и 

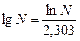 получаем:
получаем:

 Дж/моль.
Дж/моль. Дж/моль.
Дж/моль. Дж/моль.
Дж/моль. 

 кДж/моль.
кДж/моль. (28)
(28)
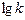
 (см. рис. 1).
(см. рис. 1).
 находим из графика:
находим из графика:
 Дж/моль.
Дж/моль. .
. 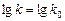 .
.
 .
.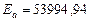 Дж/моль,
Дж/моль,  .
.