|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Тема: Реакційна здатність алканів, алкенів, аренів
Актуальність теми: Насичені, ненасичені і ароматичні вуглеводні є органічними речовинами, знання будови і властивостей яких допомагає зрозуміти будову і властивості органічних сполук із яких складаються живі організми. Навчальні цілі: Знати класифікацію органічних сполук, номенклатуру ІЮПАК, гібридизацію атома Карбона, типи хімічних зв’язків і типи хімічних реакцій, характерних для молекул алканів, алкенів,аренів. Вміти: дати назву речовини, визначати клас органічної сполуки і відношення їх до реакцій заміщення, приєднання, окислення.
Самостійна позааудиторна робота: 1. Алкани. Гомологічний ряд. 2. Електронна будова насичених вуглеводнів. Гібридизація. σ-зв’язок. 3. Фізичні властивості акланів. 4. Хімічні властивості. Механізм реакцій заміщення (SR). 5. Реакції відщеплення (Е). 6. Реакції окиснення. Горіння. 7. Алкени. Гомологічний ряд. Ізомерія. π-зв’язок. 8. Хімічні властивості. Механізм реакцій приєднання. 9. Правило Марковнікова. 10. Реакції окиснення. 11. Реакції полімеризації. 12. Будова молекули бензолу. 13. Механізм реакції заміщення в ароматичному ядрі. 14. Реакції окислення бензолу і толуолу. 15. Взаємний вплив атомів в молекулі толуолу.
Контрольні питання. 1.Які є типи розриву хімічних зв`язків.? 2. Що таке вільні радикали, нуклеофіли та електрофіли (визначення, приклади). 3. Як проходить радикальне заміщення біля насиченого атома карбону (SR); механізм реакції галогенування; біологічне значення вільних радикалів. 4. Як відбувається електрофільне приєднання до ненасичених сполук (АЕ); механізм реакції галогенування; значення цієї реакції. 5. Що таке електрофільне заміщення в ароматичних сполуках (SE); механізм реакції галогенування; значення реакції заміщення в бензольному ядрі. Вплив замісників на реакційну здатність аренів.
РОЗДІЛ 12 ОКСИГЕНВМІСНІ ОРГАНІЧНІ СПОЛУКИ До оксигенвмісних органічних сполук, молекули яких складаються з атомів вуглецю, водню і кисню, належать спирти, феноли, альдегіди, кетони, складні ефіри, вуглеводи та ін. Їх хімічні властивості визначаються наявністю функціональних груп. Спирти. СПИРТИ – це органічні сполуки, які складаються з вуглецю, водню і мають одну або декілька гідроксильних груп (–ОН). У спиртах гідроксильна група знаходиться при атомі вуглецю в sp3- гібридизації. Гідроксильна група (-ОН) являється функціональною групою і визначає основні властивості спиртів. Якщо група одна, то спирти називаються одноатомними (один атом водню заміщений на гідроксил). Якщо спирти містять дві або більше груп –ОН, вони називаються багатоатомними.
За розміщенням гідроксильної групи у вуглецевому ланцюзі спирти класифікують на первинні(група –ОН розміщена при первинному атомі вуглецю), вторинні (гідроксильна група розміщена при вторинному атомі вуглецю) і третинні (група –ОН знаходиться при третинному атомі вуглецю):
Одноатомні спирти Одноатомні спирти (R-OH) мають загальну формулу CnH2n+1-OH і суфікс – ол. Гомологічний ряд спиртів
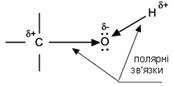
Фізичні властивості Спирти мають більш високі температури плавлення та кипіння, більшу розчинність у воді, ніж відповідні вуглеводні Така різка відмінність фізичних властивостей спиртів від алканів зумовлена в першу чергу тим, що спирти є полярними сполуками (атом кисню більш електронегативний в порівнянні з атомом вуглецю, тому він зміщує до себе електронну густину від атома вуглецю і водню). Вони мають два полярні зв’язки С-О та О-Н. Існування на атомах гідроксильної групи часткових зарядів різного знаку приводить до міжмолекулярної взаємодії гідроксильних груп і утворення водневих зв’язків:
У результаті такої взаємодії відбувається асоціація молекул спирту. Водневі зв’язки значно слабші за ковалентні, однак їх утворення істотно зменшує леткість, підвищує температуру кипіння, тому що агрегати, які утворюються, мають більшу молекулярну масу. Наприклад, етан кипить при -89°С, тоды як етанол при 78,5 °С. Метанол і етанол змішуються з водою в будь-яких співвідношеннях; зі збільшенням молекулярної маси розчинність спиртів у воді зменшується.
Одержання Етанол одержують: 1) гідратацією етилену: СН2=СН2 + Н2О → СН3–СН2–ОН етен етанол 2) бродінням крохмалю (або целюлози): крохмаль ® С6Н12О6––ферменти→2С2Н5ОН + 2СО2 Джерелом крохмалю є зерно, рис, картопля. Хімічні властивості Властивості спиртів R-OH визначаються наявністю полярних зв'язків Oδ-–Hδ+ і Cδ+–Oδ-, і неподілених електронних пар на атомі кисню.
Для спиртів характерні реакції за участю зв’язку О-Н, зв’язку С-О і окиснювальні реакції.
Поиск по сайту: |