 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Будова молекули бензолу (бензену)
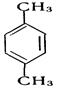
Бензол має склад молекули С6Н6 і належить до групи ароматичних вуглеводнів. Ця назва, як і багато інших в органічній хімії, склалася історично, оскільки перші з добутих сполук цієї групи справді мали приємний запах. Будова молекули бензолу багато років становила теоретичну проблему, жодна із запропонованих структурних формул не відповідала властивостям речовини, що спостерігалася вченими в лабораторії. Німецький учений А. Кекуле запропонував формулу, що найкраще відобразила рівноцінність і атомів Карбону, і атомів Гідрогену: Для позначення молекули бензолу найчастіше користуються формулою Кекуле, пам’ятаючи про її недосконалість. Гомологи бензолу. Ізомерія. Гомологи бензолу можна розглядати як похідні бензолу, в яких один або декілька атомів вуглецю заміщені різними вуглеводневими радикалами. Найближчий гомолог бензолу – С6Н5СН3 метилбензол (толуол); як і бензол, толуол не має гомологів. Наступний гомолог бензолу С6Н4(СН3)2 – диметилбензол (ксилол) має три ізомери, які відрізняються положенням метильних груп. Скорочення „о-”, „м-”, „п-” означають „орто-”, „мета-”, „пара-”:
о-диметилбензол м-диметилбензол п-диметилбензол орто-ксилол мета-ксилол п-ксилол 1,2-диметилбензол 1,3-диметилбензол 1,4-диметилбензол В орто-положенні метильні групи знаходяться біля сусідніх атомів вуглецю, в мета-положенні – через один атом вуглецю, в пара-положенні – через два. При заміщенні одного атома водню на радикал вініл (-СН=СН2) утворюється вінілбензол або стирол С6Н5-СН=СН2. Стирол легко полімеризується, утворюючи полістирол. При полімеризації відбувається розрив подвійного зв’язку вінілу. Фізичні властивості За звичайних умов бензол – рідина зі специфічним запахом, tкип. 80°С, у воді практично нерозчинний, хоча є розчинником багатьох органічних речовин. Через високий вміст вуглецю ароматичні вуглеводні горять сильно кіптявим полум’ям. Бензол дуже отруйний. Тривале вдихання його парів викликає лейкемію. Хімічні властивості Завдяки єдиній електронній хмарі, що стабілізує бензольне ядро, бензол виявляє стійкість проти дії окисників, не знебарвлює розчин перманганату калію. Цим бензол нагадує насичені вуглеводні, хоча формально є ненасиченою сполукою. Як і насичені сполуки бензол вступає в реакції заміщення, внаслідок чого атоми водню можуть заміститися, наприклад на атоми хлору. І. Реакції заміщення: 1)галогенування Заміщення атома водню в бензольному ядрі на атом хлору здійснюють дією вільного хлору або брому в присутності каталізатора AlCl3, FeBr3 та інш.
2) нітрування –це процес заміщення атомів водню на нітрогрупу–NO2 .Як нітруючі реагенти в реакції нітрування частіше використовують концентровану азотну кислоту або суміш концентрованих азотної та сірчаної кислот (нітруючи суміш). З концентрованою азотною кислотою бензол і його гомологи реагують повільно. Тому для нітрування аренів найширше застосовується нітруючи суміш:
3) сульфування –це процес заміщення атома водню в бензольному ядрі на сульфогрупу – SO3H. Для сульфування бензолу та його гомологів частіше використовують концентровану сірчану кислоту або димлячу сірчану кислоту (олеум):
ІІ. Реакції приєднання. Порівняно з ненасиченими вуглеводнями, для яких характерні реакції приєднання, бензол вступає в ці реакції у значно жорсткіших умовах. За наявності каталізатора до молекули бензолу приєднюються шість атомів Гідрогену:
1) гідрування:
Галогенування При інтенсивному сонячному освітленні або під дією ультрафіолетового випромінювання бензол приєднює хлор:
Поиск по сайту: |
 . Проте і ця формула неповністю відповідає реальній структурі молекули бензолу. Після з’ясування електронної будови молекули бензолу формулу почали записувати таким чином:
. Проте і ця формула неповністю відповідає реальній структурі молекули бензолу. Після з’ясування електронної будови молекули бензолу формулу почали записувати таким чином:  . Цю формулу запропонував Полінг. Мається на увазі, що атоми карбону розміщуються в кутах шестикутника і сполучені з атомами гідрогену. Кільце всередині шестикутника показує, що в молекулі існує єдина шестиелектронна хмара, утворена електронами, наданими у спільне користування шістьма карбоновими атомами (по одному електрону кожним атомом). Зв’язки між атомами Карбону не є простими чи подвійними в чистому вигляді. Через це бензол не належить ні до насичених, ні до ненасичених вуглеводнів, а є представником нової групи – ароматичних вуглеводнів.
. Цю формулу запропонував Полінг. Мається на увазі, що атоми карбону розміщуються в кутах шестикутника і сполучені з атомами гідрогену. Кільце всередині шестикутника показує, що в молекулі існує єдина шестиелектронна хмара, утворена електронами, наданими у спільне користування шістьма карбоновими атомами (по одному електрону кожним атомом). Зв’язки між атомами Карбону не є простими чи подвійними в чистому вигляді. Через це бензол не належить ні до насичених, ні до ненасичених вуглеводнів, а є представником нової групи – ароматичних вуглеводнів.

 + Cl2 –AlCl3®
+ Cl2 –AlCl3®  хлорбензен + HCl
хлорбензен + HCl нітробензен + H2O
нітробензен + H2O сульфобензен + H2O
сульфобензен + H2O циклогексан
циклогексан
 гексахлорциклогексан, хлоран
гексахлорциклогексан, хлоран

 сим-трихлорбензен
сим-трихлорбензен