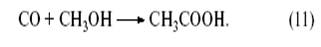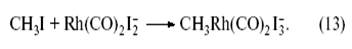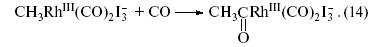|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Типы легандов в комплексных соединениях
K[PtCl3(C2H4)] – первое соединение, описанное в литературе, содержащее молекулу этилена, связанную с атомом металла за счет пары π-электронов этилена (соль Цейзе). Комплексы металлов с органическими лигандами CH+5 и с производными бензола (аренами) были синтезированы в 1951 – 1955 гг. Их структура была весьма необычна для того времени: органические ароматические лиганды оказались связаны как π-лиганды с центральными атомами металла.
За вклад в развитие этой области химии Дж. Уилкинсон и Э.О. Фишер получили Нобелевскую премию. Степень окисления металла в комплексах может быть положительной (PdCl2-4, Ni (H2O)2+6, HPtCl(PR3)2, K2ReH9, K3W(CH3)6), равняться нулю (Ni (CN4-4), Ni(CO)4, Cr(C6H6)2) или даже быть отрицательной (Na2Fe(CO)4). К фундаментальным открытиям последнего времени следует отнести синтезы стабильных комплексов с молекулярным водородом (Г. Кубас, 1984), в которых молекула Н–Н связана с металлом за счет своей пары электронов (без разрыва связи Н–Н) (аналогично связи CH+3 c H2): W(CO)3(PR3)2(H2), Ir (H)2 (H2)2 PR3 +2. Помимо комплексов с одним центральным атомом металла известны комплексы состава MmLn. Это комплексы с мостиковыми лигандами.
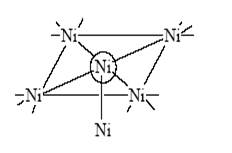
и комплексы со связями М–М (кластеры металлов). Связи металл–металл в кластерах имеют различную кратность[11]:
Двойные и тройные связи близки по свойствам к π-связям в органических (C2H4, C2H2) и неорганических (N2) молекулах. В отличие от иона H+ ионы переходных металлов могут координировать до 9 лигандов, то есть связывать несколько молекул и фрагментов молекул в координационной сфере металла. При этом атом или ион переходного металла может быть не только акцептором пары электронов Рассмотрим механизм реакции карбонилирования метанола, которая является сегодня лучшим методом получения уксусной кислоты.
В этом процессе действуют два катализатора – металлокомплексный Rh(I) и кислотный (HI). Метанол реагирует с HI с образованием CH3I и H2O:
Иодистый метил присоединяется к комплексному аниону Rh (CO2)I-2 с образованием комплекса Rh(III) со связью CH3−Rh:
В полученном комплексе Rh(III) мы видим группу CH3 и координированные родием молекулы СО. Далее происходит замечательная внутрисферная реакция объединения двух групп (CH3 и CO) – реакция внедрения СО по связи CH3–Rh. Атакующая комплекс Rh(III) молекула СО занимает координационное место, освободившееся после связывания СО группой CH3. Образующийся ацетильный фрагмент (CH3CO) остается связанным родием(III):
Затем происходит внутрисферная реакция объединения ацетильной группы с атомом иода (восстановительное элиминирование) с возвращением исходной формы катализатора и гидролиз иодангидрида уксусной кислоты с образованием HI и CH3COOH:
Таким образом, Rh(I) катализирует карбонилирование CH3I до CH3COI, а HI – карбонилирование метанола до уксусной кислоты. Роль металлоорганических соединений в катализе особенно оценили после открытия гомогенных и гетерогенных катализаторов для стереоспецифической полимеризации олефинов и диенов – TiI4–Al(C2H5)3, TiCl3–Al(C2H5)3. Авторы этих каталитических систем К. Циглер и Дж. Натта. Важнейшую роль в развитии металлокомплексного органического катализа сыграло открытие реакций окисления олефинов в растворах солей палладия, о котором мы говорили выше, и изучение их механизма (И.И. Моисеев, П. Генри). Гетерогенный катализ металлами и оксидами металлов. Каталитические реакции на поверхности так же, как и реакции на поверхности электродов (электрохимия) и фотохимические процессы в тонких пленках (фотография), относятся к особой области химии – химии поверхности. В 50-е годы процессы адсорбции различных веществ на поверхности (первая химическая стадия в гетерогенном катализе) стали изучать на молекулярном уровне многочисленными физическими методами[13]. К реакциям на поверхности переходных металлов, оксидов металлов и других металлсодержащих соединений применимы все представления координационной и металлоорганической (в случае органических реакций) химии[14]. На поверхности металлов образуются первичные комплексы реагентов с атомом или группой атомов поверхности и продукты их превращений.
Например, при адсорбции этилена на поверхности кристаллического Rh происходят следующие химические реакции при изменении температуры (Г. Саморджай) (схема 2):
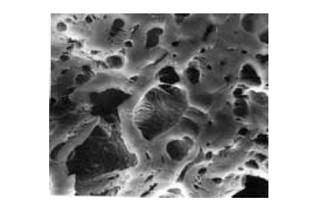
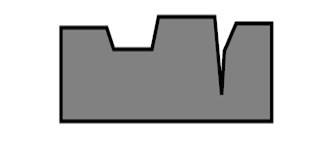
Схема 2 Адсорбированные молекулы изменяются так же сильно, как и в процессах комплексообразования (особенно с кластерами металлов). Например, молекула бензола (средняя длина С–С = 1.40 A), взаимодействуя с 4 атомами Rh на поверхности, растягивается так, что длины двух противоположных С–С-связей становятся равными 1.63 A (больше простой С–С-связи в этане), а длины 4 других С–С-связей равны 1.45 A. Помимо химических проявлений, в гетерогенном катализе следует учитывать наличие объема твердого тела (большого количества атомов) и ряд особенностей поверхности[15]. 1. Поверхность с макроскопической точки зрения является объектом с очень сложным рельефом, а твердое тело обычно имеет развитую пористую структуру. Это очень хорошо демонстрирует электронно-микроскопическая фотография поверхности активированного угля (типичный катализатор или носитель в гетерогенном катализе) (рис. 3).
Рис. 3.Электронно-микроскопическая фотография поверхности активированного угля
Даже на поверхности монокристаллов металлов существуют площадки, выступы, ступеньки и трещины (рис. 4). Это сказывается на геометрии окружения различных атомов и, естественно, на их реакционной способности.
Рис. 4. Геометрия поверхности монокристалла. 2. В случае металлического катализатора атом металла (или группа атомов) на поверхности реагирует как локальный активный центр с молекулой реагента, однако этот атом окружен другими атомами (как лигандами), которые меняют свойства реагирующего атома. Так же влияют атомы кислорода на свойства металла в оксиде.
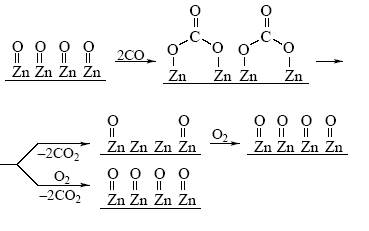
3. В решетке оксида металла присутствуют различные дефекты, примеси, что приводит к появлению небольшого количества ионов металла в более низких или в более высоких степенях окисления (в объеме и на поверхности). Например, в оксиде хрома (Cr2O3) могут присутствовать ионы Cr2+ (лишние электроны) и ионы Cr4+, Cr5+, Cr6+ (электронные вакансии). При этом реагент (молекула углеводорода, например) реагирует с Cr2+ и Cr4+ поразному, образуя гидрид-ион в первом случае (Cr3+–H–) и протон во втором (Cr3+–OH+) и радикал R (свободный или связанный с ионами хрома). 4. Свойства поверхностных соединений (двухмерный адсорбционный слой) отличаются от свойств тех же соединений, образующих обычную (трехмерную) фазу. 5. Объемная фаза твердого тела в ряде случаев также участвует в каталитическом акте. Происходит диффузия атомов из решетки к поверхности (Н, О), а также возможен перенос электронов через объемную фазу от одного центра поверхности к другому. 6. Роль локальных свойств активного центра и роль коллективных свойств твердого тела определяется типом катализатора и механизмом реакции. 7. В случае смешанных оксидов металлов или сплавов металлов концентрации компонентов в объеме и на поверхности различаются: поверхностный монослой атомов может заметно обогащаться одним из элементов (металлов). Простейший механизм реакции окисления СО на поверхности оксида цинка описывается схемой 3. Вначале происходит образование поверхностных карбонатов, распад которых ускоряется адсорбирующимся кислородом [12]:
Схема 3 Биокатализаторы – ферменты. Ферменты – это молекулы белка, которые в большинстве случаев растворимы в воде, но иногда находятся в коллоидном (микрогетерогенном) состоянии. Активные центры фермента формируются в результате стягивания в одну область пространства различных функциональных групп, принадлежащих различным аминокислотным фрагментам молекулы белка (~COOH, ~OH, ~NH2, ~SH, ~имидазол и др.). Активный центр располагается в виде щели в глобуле белковой молекулы. В некоторых ферментах и коферментах (молекулах, выполняющих роль специфических реагентов, регенерируемых в ходе реакций с другими ферментами) присутствуют ионы металлов (Fe, Cu, Zn, Mo, V, Co и др.), окруженные макролигандами. Одним из таких Co-содержащих коферментов является витамин В12. Наряду с высокой частотой оборотов фермента (А) при относительно небольшом времени жизни ферментам свойственна высокая специфичность по отношению к определенному субстрату и высокая специфичность к типу реакции. Высокие активность и селективность действия фермента достигаются благодаря высокой степени организации активного центра и некоторым особенностям действия белковых катализаторов: а) первичное связывание реагента в активном центре весьма специфично; б) молекула реагента, попав в активный центр, вызывает изменение структуры белковой молекулы и подстраивает “под себя” геометрию активного центра так, чтобы дальнейшее превращение было наиболее выгодным (протекало с большей скоростью); в) в активном центре на молекулу реагента обычно синхронно действуют несколько активных групп (кислотных, основных, нуклеофильных каталитических центров), что напоминает действие сварочных роботов на конвейере сборки автомобилей. Роль объединения различных групп в одном катализаторе и синхронного их действия давно известна и в химическом кислотно-основном катализе.
Поиск по сайту: |



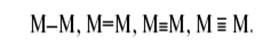
 , но и донором неподеленных пар d-электронов на лиганд
, но и донором неподеленных пар d-электронов на лиганд  что очень важно для активации координированной частицы. Активация различных молекул особенно эффективно осуществляется в кластерных комплексах[12].
что очень важно для активации координированной частицы. Активация различных молекул особенно эффективно осуществляется в кластерных комплексах[12].