 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ЕЛЕКТРОЛІТИ В ОРГАНІЗМІ ЛЮДИНИ. ЕЛЕКТРОПРОВІДНІСТЬ РОЗЧИНІВ: ПИТОМА, МОЛЯРНА, ГРАНИЧНА
Біологічні тканини і рідини містять значну кількість електролітів і мають досить високу електропровідність. Електроліти беруть участь у пластичних процесах, у підтриманні кислотно-лужного стану, у нормалізації водно-сольового обміну та осмотичного тиску. Вивчення електролітичних порушень при багатьох захворюваннях, виникнення електродних потенціалів та їх своєчасна корекція іноді є вирішальним для успішного лікування. Електропровідність – це здатність речовини проводити електричний струм. Електропровідність L – це величина обернена опору провідника струму:
Електропровідність відбувається за рахунок електронів чи йонів і відповідно розрізняють провідники 1-го роду і 2-го роду. Провідники 1 роду – майже всі метали, карбіди і нітриди металів, графіт, йод, і деякі оксиди. Вони проводять електричний струм за рахунок електронів і при цьому не змінюються. Провідники 2 роду – це розчини кислот, основ, солей, які називають електролітами. Проведення електричного струму відбувається за рахунок руху заряджених йонів. Швидкість руху йонів менша, ніж електронів в провідниках 1 роду і при цьому відбувається розклад провідників за рахунок проходження хімічних реакцій. Визначення електропровідності зводиться до вимірювання опору шару даного електроліту, що знаходиться між двома електродами. Для того, щоб порівняти провідність різних розчинів електролітів вводять питому електропровідність(“χ” – гр. “капа”) –електропровідність 1 м3 розчину електроліту, розміщеного між двома електродами, що мають площу 1 м2 і віддалені один від одного на 1м. χ де ρ – питомий опір, Ом/м В реальних умовах вимірюють опір, який залежить від довжини провідника (l) і площі його поперечного перерізу (S): або при постійних значеннях l і S: Тоді де К – константа електродної посудини.
СН3СООН
С, моль/л Залежність питомої електропровідності від концентрації та сили електроліту. Питома електропровідність залежить від концентрації електроліту і від сили електроліту. Так, зі збільшенням концентрації електроліту χ збільшується, досягаючи певного максимального значення і при подальшому збільшенні концентрації електропровідність зменшується. Чому? За рахунок утворення йонної атмосфери, що приводить до зменшення кількості активних йонів. Для слабких електролітів при досягненні певної концентрації починається зменшуватись ступінь іонізації (α) і відповідно зменшується електропровідність. Електропровідність залежить від температури і її підвищення призводить до зростання електропровідності. Залежність від концентрації виражається молярною (еквівалентною)електропровідністю (λС). Це електропровідність 1 моля (1 еквіваленту) розчиненого електроліту розміщеного між електродами на віддалі 1 м.
якщо χ в Cм/м, а С – концентрація моль/м3, або якщо С в моль/л
Молярна електропровідність досягає максимуму коли всі молекули розпадуться на йони. При такому розведенні, яке називають граничним, електропровідність залежить тільки від природи електролітів. Це дозволило Ф. Кольраушу встановити закон, в якому гранична електропровідність складається із незалежних одна від одної рухливостей катіонів і аніонів: λ∞ = λ+ + λ- Вимірювання електропровідності дозволяє встановити ступінь дисоціації, якa буде пропорційна електропровідності:
Значення величини λс, яку можна встановити вимірюванням опору розчину (R) и λ∞, яку можна розрахувати взявши дані про рухливість аніонів і катіонів із довідника, дозволяє визначити практичне значення константи дисоціації.
Вимірювання електропровідності є основою кондуктометричних методів аналізу, які дуже зручні і доступні. За допомогою кондуктометричного титрування можна визначити точку еквівалентності за зміною електропровідності розчину. Так можна визначити кислотность шлункового соку який, як відомо, є розчином, що містить йони Н+ і СІ‾.. Ці йони мають велику рухливість, відповідно, велику електропровідність. При дії на пробу шлункового соку розчином NaOH спостерігається зменшення кількості Н+, за рахунок утворення малодисоційованої речовини – Н2О:
V1 VNaOH Крива титрування.. Н+ + ОН‾ → Н2О Це призведе до зменшення електропровідності аж до точки еквівалентності, де електропровідність найменша. При подальшому додаванні NaOH збільшується кількість рухливих йонів ОН‾ електропровідність зростає, це відображається на кривій титрування, яка дозволяє визначити точку еквівалентності. Електропровідність різних тканин і біологічних рідин неоднакова. Добре проводять струм спинно-мозкова рідина, лімфи, кров. Нижча електропровідність тканин легень, серця, печінки. Дуже низька електропровідність у жирової і кісткової тканини. За визначенням питомої електропровідності сечі можна визначити наявність в ній неелектролітів – глюкози, цукру. Адже при різних патологіях спостерігається відхилення електропровідності від норми. Окисно-відновні процеси. Процеси, що супроводжуються зміною ступеня окислення атомів, називаються окисно-відновними. При цьому в реакціях беруть участь окисники і відновники. Відновниками – називають речовини, які в процесі реакції віддають електрони. Окисники – приймають електрони. Такі процеси відіграють надзвичайно важливу роль в процесах обміну речовин, які відбуваються в організмі людини, забезпечуючи організм енергією. В організмі людини розрізняють 3 типи окисно-відновних реакцій: 1) з участю атомів оксигену, утворенням ними нових зв’язків з атомами карбону:
2) ферментативне дегідрування:
Особливістю біологічного окислення є те, що воно проходить ступінчато через ряд проміжних окисно-відновних стадій, кожна з яких характеризується своїм окисно-відновним потенціалом. Вимірювання біопотенціалів покладено в основу таких методів як електрокардіографія, електроенцефалографія і ін. Електрохімічні методи аналізу знайшли широке застосування в медико-біологічних дослідженнях. Тому знання основ електрохімії необхідне лікарям для повноцінної лікарської діяльності. Як виникає електродний потенціал? Якщо занурити металеву пластинку в розчин власної солі, то можливі два протилежні процеси: а) перехід йонів металу із пластинки в розчин під дією диполів води:
б) осадження йонів Меn+ на пластинці:
Меn+ + nē → Ме У розведених розчинах швидкість переходу йонів з металу в розчин більша, ніж швидкість зворотного процесу, яка можлива при високих концентраціях Меn+ При цьому зменшується кількість позитивно заряджених йонів на металі, які перейдуть в розчин, а на металі буде негативний заряд, і чим більша буде різниця v1-v2 тим негативнішим буде заряд електроду. Рівноважний стан різниці потенціалів на межі метал-розчин називають електроднимпотенціалом Виміряти електродний потенціал можна лише помістивши його в замкнуте коло із іншим електродом який називають електродом порівняння за допомогою приладу, який дуже чутливий до вимірювання різниці потенціалів – гальванометра. Абсолютні значення окисно-відновних потенціалів виміряти неможливо, тому порівнюють різні окисно-відновні пари із стандартною парою (стандартним електродом). За стандартний електрод прийнятий нормальний водневий електрод. Стандартний водневий електрод – це платинова пластинка занурена в розчин H2SO4 з активністю йонів Н3О+, що дорівнює одиниці при T=298 К. Платинова пластинка насичується воднем під тиском 1 атм. При цьому проходить реакція Н2 – 2е→2Н+ Pt, Н2/2Н+ Е0=0 Електроди, які застосовуються, в залежності від типу оборотності та числа фаз діляться на кілька груп. Електроди І роду. Це металеві пластинки занурені в розчин власних солей. Ці електроди оборотні відносно катіона або аніона і двохфазні. Схематично записують: Ме/Меn+ Електроди ІІ роду складаються із металу покритого його важкорозчинною сполукою (сіллю, оксидом, гідроксидом) і зануреного в розчин добре розчинної сполуки з тим же аніоном. Схематично зображають так: Ме/МеAn, Ann- Ці електроди оборотні як відносно катіона так і відносно аніона, однак можна змінювати концентрацію тільки аніона і тільки таким чином впливати на величину потенціалу. Найбільш широке застосування мають хлорсрібний і каломельний електроди. Хлорсрібний складається із срібної дротини покритою шаром АgCI і зануреної в розчин КСІ. Аg/АgCI, КСІ Такий електрод має власний потенціал +0,202 В і використовується як електрод порівняння для проведення серійних вимірювань потенціалу. Для дуже точних визначень користуються каломельним електродом, але оскільки метал в цьому електроді – Hg, то він є дуже отруйний і не використовується дуже широко. Уявлення про окисно-відновні потенціали необхідні при вивченні окисно-відновних процесів в організмі. Біологічне окислення є основним джерелом енергії в організмі і має багатоступінчатий характер. Воно може відбуватись шляхом перенесення електронів або протонів. Стандартизація окислювально-відновних біохімічних потенціалів в біохімії відрізняється від електрохімічних. Їх проводять при активності а = 1 моль/л , T = 298 К , та рН = 7. Стандартні окисно-відновні потенціали позначають Е0І. Їх величина виражається у вольтах і пов’язана із стандартним електрохімічним потенціалом таким співвідношенням: Е0І= Е0 – 0,059*рН = Е0 – 0,059*7 = Е0 – 0,42 В. Таким чином для системи Н2/2Н3О+ + 2е стандартний редокс-потенціал Е=-0,42 В Від’ємне значення редокс-потенціалу свідчить про відповідні властивості: чим більше від’ємне значення редокс-потенціалу, тим сильніша здатність даної пари віддавати електрони, тобто бути відновником. І навпаки, чим позитивніший редокс-потенціал, тим сильніше проявляється здатність окисно-відновної системи приймати електрони і відігравати роль окисника. Наприклад, редокс-потенціал пари, яка складається із нікотинамідаденіннуклеотиду НАДН/НАД+ дорівнює –0,32 В, що свідчить про її високу здатність віддавати електрони, а редокс-потенціал пари 0,5О2/Н2О має додатню величину +0,81 В., тому кисень проявляє високу здатність приймати електрони. Величина окисно-відновного біохімічного потенціалу дає змогу передбачити напрямок потоку електронів під час біологічного окислення та розрахувати зміну енергії при переносі електронів від однієї редокс-пари до другої. Йонселективні електроди. Важливе практичне значення потенціометрії виявилось в застосуванні електродів, які дають можливість визначати активність певного виду йонів в розчинах. Такі йони називають потенціалвизначаючими, а електроди – йонселективними (“селективний” – вибірковий). Їх ще називають мембранними електродами за застосування мембрани, яка може змінювати свій потенціал через різницю концентрацій у внутрішній і зовнішній її частині певного виду йону. Найбільшого поширення набули скляні електроди, виготовленні із спеціального скла, з якого одержують скляну кульку, припаяну до скляної трубки. В середині електрода знаходиться розчин НСІ певної концентрації йонів Н+ в який занурюють допоміжний електрод, найчастіше хлорсрібний. Це зумовлено хімічною природою мембрани, яка тут є спеціальним склом, в якому йони лужних металів обмінюються на йони водню з розчину. Таким чином, на межі контакту виникає потенціал за рахунок різниці концентрацій. Та як потенціал залежить від активності йонів Н+, то їх називають скляними електродами з водневою функцією і використовують для визначення рН розчину. На такому ж принципі працюють і електроди, які дозволяють визначати катіони чи аніони. Всередині такого електроду знаходиться розчин йону, який визначають. В матеріалі мембрани теж містяться визначувані йони. Це дає можливість визначати концентрацію великої кількості різних йонів.
В гальванічних колах, які складаються із двох напівелементів, що відрізняються або складом розчинів, або потенціалом крім потенціалів на межі електрод-розчин - виникає додатковий потенціал на межі розчин-розчин. Це дифузійний потенціал і причина його виникнення полягає у різній швидкості руху катіона і аніона. Н+; ОН- - найбільш рухливі, інші катіони і аніони володіють значно нижчою рухливістю. Близький за природою є мембранний потенціал, який виникає на напівпроникній перегородці , яка вибірково пропускає катіони і затримує аніони. Це приводить до нагромадження по обидві сторони мембрани зарядів протилежного знаку. Такі потенціали досить стійкі. Вони виникають у клітинах рослинних і тваринних організмів і приводить до утворення різних біопотенціалів та біострумів. Існуюча відмінність у йонному складі всередині і зовні клітини приводить до появи і ще одного потенціалу.
Використовуючи значення цих концентрацій в рівнянні Нернста можна розрахувати потенціал, який має – 75 МВ. Цей потенціал, виміряний у стані фізіологічного спокою клітини, називають потенціалом спокою. Якщо нервову тканину збуджувати електрично, хімічно чи механічно, клітинна мембранна стає більш прониклою для йонів Na+, що приводить до зміни мембранного потенціалу, який становить 50 МВ. Отже, між мембранний потенціал змінюється від –75 до +50 МВ. Таке раптове підвищення чи зниження мембранного потенціалу називають потенціалом дії. Потенціали дії створюють струм (біопотенціали та біоструми), тому два електроди, прикладені до різних ділянок тіла, реєструють різницю потенціалів. Це покладено в основу електрокардіографічних і інших методів діагностики. Гальваноз. В ортопедичній стоматології для виготовлення зубів використовують близько 20 металів. Якщо у ротовій порожнині знаходяться протези з різних металів, то при змочуванні їх слиною утворюється гальванічний елемент. Електричний струм, що виникає під час його роботи приводить до появи паталогічних процесів, що дістали назву гальваноз. При цьому спостерігається металевий присмак, відчуття кислоти, зіпсуття смаку та слиновиділення. Хімічні реакції, які відбуваються при цьому можуть привести до появи алергічних захворювань, захворювань печінки, шлунково-кишкового тракту і інших хвороб. Тому сумісне застосування різних металів і різних сплавів недопустимо. Приклади розв’язування задач. Задача 1. Питома електропровідність оцтової кислоти з молярною концентрацією еквівалентів 0,01 моль/л при 298 К = 1,56*10-2 См/м. Розрахувати ступінь і константу дисоціації даної кислоти, а також рН цього розчину. Розв’язок. 1. Розраховуєм молярну (еквівалентну) електропровідність (λс)
Якщо С в моль/л, то враховуючи, що 1 м3 = 1000 л, то
2. Розраховуєм граничну електропровідність розчину використовуючи дані довідника враховуючи, що дисоціація: СН3СООН=Н++СН3СОО-
3. Розраховуєм ступінь дисоціації:
4. Розраховуємо константу дисоціації:
Задача 2. Визначити константу електродної посудини, питому і молярну електропровідності розчину AgNO3 з молярною концентрацією 0,1 моль/л, якщо його опір 1090 Ом, а в тих же умовах розчин КСІ з молярною концентрацією еквівалентів 0,02 моль/л має опір 431 Ом, а питома електропровідність його рівна 2,77*10-2 См*м-1 Розв’язок. Визначення питомої електропровідності розчину в електродній посудині можна провести за формулою:
Знаючи питому електропровідність стандартного розчину КСІ і його опір можна визначити сталу даної електродної посудини:
Знаючи К посудини можна визначити опір досліджуваного розчину АgNO3
Молярна електропровідність λ зв’язана з питомою:
ЗАНЯТТЯ №13 Тема: Розчини електролітів. Електроліти в організмі людини. Електропровідність розчинів:питома, молярна, гранична. Актуальність теми:Здатність розчинів електролітів проводити електричний струм широко використовується в біології і медицині для діагностики і в лікувальній справі. Знання закономірностей електропровідності різних електролітів залежить від різних факторів, можливість вимірювати опір розчинів за допомогою доступних вимірювальних приладів робить даний метод необхідним для професійної підготовки лікарів. Навчальні цілі: Знати: залежність електропровідності розчинів від природи і різних факторів, взаємозв’язок між різними видами електропровідності, ступенем дисоціації і константою дисоціації. Вміти: визначити опір розчину, питому і молярну електропровідність, ступінь дисоціації і константу дисоціації через вимірювання опору розчинів електролітів. Самостійна позааудиторна робота студентів. 1. Електропровідність. Провідники 1-го і 2-го роду. 2. Електропровідність розчинів сильних і слабких електролітів. Фактори, що впливають на електропровідність. 3. Питома і молярна (еквівалентна) електропровідність розчинів. 4. Електропровідність при безмежному розведенні. Гранична електропровідність. Закон Кольрауша. 5. Вимірювання електропровідності за допомогою електродної посудини. Постійна електродної посудини. 6. Розмірність питомої і молярної електропровідності та рухливості йонів. 7. Розрахунок ступеня і константи електролітичної дисоціації через електропровідність. 8. Електропровідність клітин і тканин, їх біомедичне значення. Контрольні питання. 1. Електропровідність сильних і слабких електролітів. 2. Від яких факторів залежить електропровідність розчину? 3. Провідники 1-го і 2-го роду. 4. Постійна електродної посудини. 5. Що таке питома електропровідність? 6. Як змінюється питома електропровідність зі зміною концентрації розчинів сильних і слабких електролітів? 7. Що таке молярна електропровідність? Як зв’язані між собою питома і молярна електропровідність? 8. Як гранична еквівалентна електропровідність зв’язана з електричною рухливістю йонів? 9. Що таке гранична електропровідність? Закон Кольрауша. 10. Опір розчину AgNO3 з молярною концентрацією еквівалентів 0,1 моль/л при 298 К рівний 1090 Ом, а опір КСl з молярною концентрацією еквівалентів 0,02 моль/л в тій же електродній посудині при тих же умовах 4318 Ом, питома електропровідність його рівна 2,77.10-3 Ом-1.см-1. Розрахувати постійну електродної посудини, питому та еквівалентну електропровідність розчину AgNO3. 11. Питома електропровідність розчину пропіонової кислоти з концентрацією С(1/1С2Н5СООН) = 7,8.10-3 моль/л дорівнює 1,21.10-4 Ом-1.см-1. Обчислити ступінь і константу дисоціації пропіонової кислоти.
Поиск по сайту: |
 де R – опір провідника. Розмірність 1 Ом-1 = 1 См (сименс).
де R – опір провідника. Розмірність 1 Ом-1 = 1 См (сименс). [См*м-1]
[См*м-1]

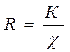 , звідки
, звідки 

 χ НСІ
χ НСІ NaOH
NaOH


 [См*моль-1*м2]
[См*моль-1*м2]

 χ
χ



 v1
v1

 Меn+
Меn+



 , де С молярна концентрація в моль/м3.
, де С молярна концентрація в моль/м3.



 , де К – стала посудини, R – опір,
, де К – стала посудини, R – опір,  - питома електропровідність.
- питома електропровідність.

