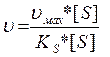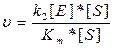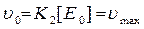|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Теорія активних комплексів
Для визначення швидкості і напрямку хімічної реакції основним є енергія активації. Швидкість будь-якої хімічної реакції залежить від числа зіткнень реагуючих речовин за одиницю часу. Якби всі зіткнення супроводжувались взаємодією, то реакції протікали б за дуже короткий час. Однак реакція відбувається лише при протіканні ефективних зіткнень, число яких в порівнянні з реальним мале. Це зумовлене тим, що в реакцію вступає та частина молекул, що мають підвищений запас кінетичної енергії. Такі молекули називають активними, а енергію, якою повинні володіти такі молекули - енергією активації. Найчастіше лише певна кількість молекул мають достатню енергію активації і тому можуть вступати в реакцію. Теорію активації, тобто здатність вступати в реакцію активних молекул, висунув С. Арреніус (1889р). Він запропонував зв’язати константу швидкості хімічної реакції з температурою таким рівнянням: K=Aе-Еа/RT де K - константа швидкості реакції моль/л*с А - предекспоненціальний множник, чисельно рівний тому найбільшому значенню константи K, яке б вона мала, якби всі без виключення молекули були активними. Еа - енергія активації Дж/моль. R - універсальна газова постійна 8,314 Дж/моль*К. T - абсолютна температура. е - основа натурального логарифму В логарифмічному вигляді:
або для десяткових логарифмів
і позначивши – Ea / R 2,303=а і lgА=в одержим спрощене рівняння Арреніуса lgK=в + а/T де а і в постійні, які можна визначити, побудувавши графічну залежність величини lgK від 1/Т тої чи іншої реакції. Так як логарифмічні рівняння відображаються у вигляді прямої, то побудувавши графік реальної залежності lgK від 1/Т можемо визначити константи а і в. З графіка знаходимо Звідси можна знайти Еа: Еа=-R*tgj
j
Рис. 3.3 Графік залежності lgK від 1/Т Якщо розглядати хімічну реакцію як процес, що супроводжується розривом старих зв’язків і утворенням нових, то енергію активації можна розглянути як енергію розриву старих зв’язків. При цьому енергія, яка виділяється в ході проведення реакції, частково або повністю компенсує енергію затрачену на збудження реакції. Але тоді енергія активації більшості молекул повинна бути більшою, ніж та, що спостерігається на практиці. Це може бути пояснено тим, що ці процеси проходять не відособлено, а при їх взаємному впливі. При цьому першою стадією хімічного процесу є стадія утворення нестійкої проміжної сполуки - активованого (активного) комплексу. Це комплекс, у якому ще не зникли зв’язки між молекулами, що вступають в реакцію і новими молекулами. Утворення такого комплексу вимагає менших затрат енергії, ніж просто розрив зв’язків із вихідних сполук. Таким чином, утворення активованого комплексу приводить до зменшення висоти бар’єру енергетичної активації. Якщо Еа < 20 кДж/моль, то реакції проходять при температурі до 50 0С. Еа > 120 кДж/моль, то t > 250 0C. Наявність каталізатора, який будучи введений в реакційну систему різко змінює швидкість реакції, має важливе значення для протікання багатьох хімічних і біохімічних процесів. Якщо розглянути хімічну реакцію як процес затрати енергії на зниження бар’єру енергії активації, то речовини, які допомагають знижувати енергію активації, називають каталізаторами. Якщо каталізатор приводить до прискорення хімічної реакції, то такий каталіз називається позитивним, якщо реакцію сповільнює, то це негативний каталіз. Якщо ж прискорення проходить в результаті утворення каталізатора в процесі реакції, то така реакція буде автокаталітичною. Види каталізу: 1) гомогенний; 2) гетерогенний; 4) мікрогетерогенний. Мікрогетерогенний каталіз зв’язаний в основному з ферментативними процесами. В світі тварин і рослин, де всі хімічні процеси проходять при звичайних умовах (р,t), всі хімічні процеси каталізуються ферментами, що є білками. У процесах, що протікають в присутності таких каталізаторів немає типового розділу фаз , в той же час реакція не є гомогенна, а білки утворюють псевдоколоїдні розчини. Важливою властивістю каталізатора є відсутність його впливу на величину константи рівноваги реакції. Каталізатор може тільки змінювати швидкість реакції, але не зміщувати її. Гомогенний каталіз протікає в одній фазі (газоподібній чи рідкій) як і реагуючі речовини . Каталізатор і реагенти знаходяться в йонному і молекулярному стані, між ними немає поверхні розділу. Приклади гомогенного каталізу: 1) окислення so2 в so3 за допомогою газоподібних оксидів азоту. 2) гідроліз дисахаридів при участі невеликих кількостей сильних кислот і ін. Більшість дослідників схильні вважати, що основою для пояснення механізму гомогенного каталізу є теорія утворення проміжного комплексу.
Гетерогенний каталіз протікає на поверхні розділу фаз, тобто реакція йде на поверхні каталізатора. Прикладом гетерогенного каталізу служить синтез спирту із суміші СО і Н2 ( СО+2H2®CH3-OH ), процеси гідрування, дегідрування, дегідратації і ін. Ці процеси протікають в декілька стадій: 1) наближення реагентів до поверхні каталізатора; 2) адсорбція і орієнтація молекул реагента на активних центрах; 3) деформація зв’язків в молекулах; 4) хімічне перетворення в активованих молекулах; 5) десорбція і відділення продуктів реакцій з поверхні каталізатора Каталізатори можуть вступати в сполучення із реагентами багатократно, тому малі кількості каталізатора можуть змінювати великі кількості реагента , що підвищує ланцюговий механізм каталізу. Застосування каталізаторів в різних промислових процесах робить їх вигідними. Каталізатори мають специфічну вибірковість на певний вид зв’язку. Інколи може бути кілька напрямів перебігу реакції
Cu
NaOH
Ni
Різні каталізатори каталізують різні напрямки реакції. Теоретично це маловивчено, але при можливості вибору проходять реакції, які вимагають найменшої енергії активації. Таким чином, каталітична дія проявляється у зниженні енергії активації.
Рис.3.4. Вплив каталізатора на енергію активації. При цьому Е2+Е3<Е1: А+В®АВ Е1 А+К®АК Е2 АК+В®АВ+К Е3 Так реакції вимагають різної енергії активації. 1) некаталітичні реакції Еа=45-30 ккал/моль 2)каталітичні Еа=30-16 ккал/моль 3)ферментативні реакції Еа=12-8 ккал/моль Теорії каталізу Немає єдиної теорії. Вони ніби доповнюють одна іншу і відображають вчення про механізми каталізу : 1) Теорія утворення проміжного комплексу: А+К®АК АК+В®АВ+К або в загальному вигляді: k+1 k2
k-1 Проміжні сполуки утворюються на поверхні каталізатора. 2) Адсорбійна теорія. Каталітична активність проявляється при здатності каталізатора адсорбувати реагенти на активних центрах. 3) Електронна теорія каталізу полягає в тому, що при участі каталізаторів металів чи їх оксидів на їх каталітичні властивості можуть впливати ковалентні чи електроноковалентні зв’язки адсорбованих чи орієнтованих молекул, викликаючи їх деформацію, перебудову зв’язків і утворенню нових продуктів. 4) Мультіплетна теорія є зв’язуючою між адсорбційною теорією і ферментативним каталізом. Ця теорія передбачає і наявність у каталізаторів активних центрів, і здатність утворення на активному центрі каталізатора мультиплетного комплексу. При цьому повинна бути геометрична подібність активного центра каталізатора і реагуючої молекули. При утворенні мультиплетного комплексу між реагуючими молекулами виділяється енергія, необхідна для розриву зв’язків. Для порівняння 1 моль ферменту каталази при 0 0С забезпечує розклад за 1 хв. біля 5 мільйонів молекул пероксиду водню (цей процес дуже важливий для захисту живих організмів від шкідливої дії пероксиду водню, що утворюється в клітинах на певній стадії метаболізму). Для порівняння, наприклад: 1 моль колоїдної платини, що також може бути каталізатором цієї реакції, вступає за 1 хв. в розклад тільки 250-2000 молекул пероксиду водню. Для одержання аміаку із водню і азоту під дією каталізатора (губчасте залізо + АІ2О3 + К2О) треба застосовувати t - 500-550 0С і тиск 107 - 108 Па. При участі ферментів цей синтез йде при звичайних температурах і тисках в бульбочках коренів бобових рослин. В наш час відомо близько 2000 різних ферментів. Приблизно половина з них були виявлені шляхом часткової очистки і концентрації, а близько 150 ферментів вдалось виділити в чистому вигляді. В організмі необхідна взаємодія декількох тисяч ферментів, а тому вивчення діяльності тих чи інших ферментів необхідно розглядати у взаємодії із іншими. Ферментативний каталіз. Практично всі біохімічні реакції як у простих одноклітинних організмів, так і в вищих - тварин і рослин, носять каталітичний характер. Роль каталізаторів виконують ферменти (від лат. закваска) або ензими. Ферменти бувають прості і складні. Прості які мають тільки білкову структуру, а складні крім білкової мають ще небілкові компоненти, які називають простетичними групами або коферментами. Особливості ферментних каталізаторів: 1) Висока ефективність. Ферменти діють в 103 - 106 разів ефективніше, ніж небіологічні каталізатори. 2) Специфічність. Певний фермент при даних умовах каталізує тільки одну біологічну реакцію. 3) Ферменти діють при м’яких умовах проходження біохімічних процесів (t, p, pH живого організму). 4) Швидкість біохімічних реакцій залежать як від концентрації реагуючих речовин субстрата (S), так і від концентрації ферменту (Е) k+1
k-1
KS - константа дисоціації Рівняння Міхаеліса:
Для подальшого протікання реакції: k+1 k2
k-1 де Р - продукт реакції k+1 - константа швидкості утворення комплексу; k-1 - константа швидкості розпаду комплексу; k2- константа швидкості переходу комплексу в продукт реакції і фермент. Враховуючи k2 і Е можна записати вираз для стаціонарної швидкості
де Кm - константа Міхаеліса.
Кm -знаходиться експериментально, і рівна такій концентрації субстрату, при якій швидкість реакції якої рівна половині максимальної.
Константу Vmax називають числом обертів ферменту. Число обертів - це кількість молекул субстрату, які перетворюються у продукт реакції за умови, що весь фермент знаходиться у складі ферментсубстратного комплексу. Число обертів більшості ферментів становить 0,5 - 104 с-1 Значення Кm приводять норму із υm і k2, як кількісний параметр ферментативної реакції. Ця величина залежить від pH, t, природи субстрату і ін. Значення її знаходиться у межах 10-1 - 10-6 моль/л. Значення υm використовують для характеристики кількості або активності ферменту. Рівняння Міхаеліса - Ментена має два граничних випадки : · коли [S] << Km, то швидкість описується рівняннями першого порядку відносно [S]
· коли [S] >> Km, то швидкість має нульовий порядок відносно [S]
υ υmax
υ/2
Рис. 3.5 Залежність швидкості реакції від концентрації субстрату. ЗАНЯТТЯ № 12 Тема: Кінетика біохімічних реакцій. Актуальність теми:Вивчення кінетики і механізму хімічних реакцій має велике теоретичне і практичне значення як для хімії, так і для медицини. Знання факторів, від яких залежить швидкість реакції дозволить регулювати процеси, які проходять в організмі, вивчати ефективність дії лікарських препаратів. Знання умов протікання реакцій дозволяє регулювати, створювати оптимальні умови протікання реакцій. Навчальні цілі: Знати: вплив основних факторів: концентрації, температури, тиску на швидкість та напрям протікання реакцій. Вміти:. Визначати швидкість хімічної реакції, її залежність від концентрації і вплив каталізаторів. Самостійна позааудиторна робота студентів. 1. Швидкість хімічних реакцій, її вираження. 2. Вплив природи реагуючих речовин, концентрації на швидкість реакції. 3. Закон діючих мас.Фізичний зміст константи хімічної рівноваги, її вираз. 4. Константа хімічної рівноваги, способи її вираження. 5. Порядок і молекулярність хімічних реакцій. 6. Енергія активації. Каталіз і каталізатори. 7. Залежність швидкості реакції від температури і тиску. 8. Ферментативні біохімічні процеси. Ферменти, як біологічні каталізатори. 9. Ланцюгові та фотохімічні, біохімічні реакції. 10. Прогнозування зміщення хімічної рівноваги на основі принципу Ле-Шательє-Брауна-Пригожина. Контрольні питання. 1. Напишіть вираз: а) константи рівноваги; б) швидкості прямої і зворотної реакції. Для реакцій: СО2(г) + С(тв) =СО (г) N2 + O2 = 2NO N2 + 3H2 = 2NH3 CO(г) + H2O(г) = CO2(г) + H2 2SО2(г) + О2(г) = 2SО3 (г) 2NO2 = 2NO +O2 2NO + Cl2 =2NOCl 2СО + О2 = 2СО2 2Н2 + О2 = 2H2O(г) 2NO + О2 = 2NO2 С(тв) + Н2О (г) = СО + Н2 2N2O + O2 = 4NO 2. Як зміниться швидкість даної реакції, якщо: а) концентрацію одногозкомпонентівзбільшити в два рази; б) тиск системи зменшити в три рази; в) температуру підвищити з 650 до 720 К (температурний коефіцієнт 2).
Поиск по сайту: |
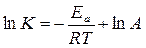

 .
. lgK
lgK

 1/T
1/T


 CH2O
CH2O CH3OH
CH3OH
 СO+H2 вищі спирти
СO+H2 вищі спирти CH4
CH4  парафіни
парафіни



 Е + S ЕS
Е + S ЕS