 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Роль ионов водорода в биологических процессах ⇐ ПредыдущаяСтр 2 из 2
Биологические жидкости содержат сильные и слабые кислоты: HCl, H2CO3, пировиноградную, молочную кислоты и другие. ^ Различают три вида кислотности в биологических жидкостях:
1. 2. 3.
Таблица 1. Интервал значений рН важнейших биологических жидкостей.
Целый ряд патологических процессов, протекающих в организме, может приводить к изменению рН некоторых биологических жидкостей. Поэтому определение рН биологических жидкостей (желудочный сок, моча и др) используются при диагностике и контроле за эффективностью терапии. Определение реакции среды и знание концентрации ионов Н+ в биожидкостях часто является необходимым в биохимических исследованиях (исследование активности ферментов). ^ Определение водородного показателя Колориметрическое определение рН основано на изменении цвета кислотно-основных индикаторов, окраска которых зависит от рН среды. Индикаторы могут быть одноцветными, имеющими окраску только в щелочной среде, а в кислой среде – бесцветные (фенолфталеин, нитрофенолы), и двухцветными, имеющими различную окраску в кислой и щелочной средах (метилоранж, феноловый красный и др.). Каждый индикатор характеризуется показателем титрования и интервалом (зоной) перехода окраски. Показатель титрования рТ – это значение рН в пределах интервала перехода окраски, при котором наблюдается наиболее резкое изменение цвета индикатора. рН), в пределах которого происходит различимое глазом изменение окраски индикатора. Граница интервала перехода приблизительно равна рТDИнтервалом перехода окраски индикатора называется интервал значений рН (индикатора 1. При определении рН раствора можно использовать только тот индикатор, в интервал перехода окраски которого входит рН исследуемого раствора.± Таблица 2 Кислотно-основные индикаторы
Обычно вначале определяют приблизительное значение рН с помощью универсального индикатора. Универсальный индикатор – это смесь нескольких индикаторов с различными, но примыкающими друг к другу интервалами перехода окраски, охватывающими шкалу рН от 1 до 14, причем эта смесь индикаторов имеет определенную окраску при тех или иных значениях рН. Универсальная индикаторная бумага – это фильтровальная бумага, пропитанная универсальным индикатором. К ней прилагается цветная шкала со значениями рН для каждой окраски. Точность определения не превышает 0,5 ед. рН. По приблизительному значению рН подбирают индикатор для более точного определения. ^ Потенциометрическое (ионометрическое) определение рН основано на измерении электродвижущей силы (ЭДС) гальванической цепи, составленной из индикаторного полуэлемента (электрода определения), потенциал которого зависит от рН среды (стеклянный, водородный, хингидронный) и электрода сравнения (хлорсеребряного, каломельного), имеющего постоянный потенциал. Измерительная шкала иономера (рН-метра) градуирована как в милливольтах, так и в ед. рН. Точность определения до 0,01 ед. рН. Можно использовать для определения рН мутных и окрашенных жидкостей. Классификация растворителей. Все растворители, согласно теории, делятся на апротонные и протолитические. Апротонные не содержат протонов и не могут служить донoрами протонов. К апротонным растворителям относятся CCl4, CS2. Протолитические растворители делятся на три группы: 1. Протогенные. Способны отдавать протоны. К ним относятся H2SO4, HNO3 и другие. 2. Протофильные. Способны принимать протоны. К ним относятся жидкий аммиак, амины и другие. 3. Амфипротонные. Способны принимать и отдавать протоны. К ним относятся H2O, C2H5OH и другие. Ионное произведение воды и водородный показатель Вода — очень слабый электролит и диссоциирует незначительно. Диссоциация Н2О – это протолитическая реакция: Н2О + Н2О ⇄ Н3О+ + ОН– основание 1 кислота 2 кислота1 основание 2 или упрощенно: Н2О ⇄ Н+ + ОН– Константа диссоциации воды при 298К, определенная методом электрической проводимости, равна: Кд(Н2О) = Вода присутствует в большом избытке, ее концентрация [Н2О] может считаться постоянной и составляет 55,6 моль/л (1000 г : 18 г/моль = 55,6 моль). Объединяем две постоянные величины Кд(Н2О) и [H2O] в одну, получаем: ^ Величину Если [H+] = [OH- ] = 10–7 моль/л, то это нейтральная среда. Если [H+[OH>] -], т.е. [H+10>] -7, то раствор имеет кислую среду. Если [H+[OH<]- ], т.е. [H+10<] - 7, то раствор имеет щелочную среду. На практике использование концентрации водородных ионов [H+] для характеристики cреды не очень удобно. Поэтому для этой цели используют отрицательный десятичный логарифм активности (концентрации) водородных ионов, называемый водородным показателем рН среды: рН = – lg a(H+) или рН = –lg[H+] Аналогично гидроксильный показатель рОН = – lg a(OH- ) или рОН = – lg[OH- ] Например, если [H+] = 10- 2 моль/л (кислая среда), то рН = 2, а когда [H+] =10-9 моль/л (щелочная среда), то рН = 9. В нейтральной среде [H+] = 10-7 моль/л и рН = 7. Из этих примеров следует, что: если рН = 7, то это нейтральная среда; если рН < 7, то это кислая среда; если рН > 7, то это щелочная среда. Логарифмируя выражение [H+][OH-] = 10–14 и проведя математические преобразования, получаем: рН + рОН = 14.
Расчет рН растворов сильных и слабых электролитов 1. Для растворов сильных кислот и оснований: а) H2SO4 2H®+ + где СН – молярная концентрация эквивалента, fa – коэффициент активности; для разбавленных растворов fa 1.» рН = – lg[H+] = – lg CH (к-ты) fa. б) Ва(ОН)2 Ва®2+ + 2ОН–, [ОН–] = CH (осн.) fa рОН = – lg[ОН–] = – lg CH (осн.) fa 2. Для растворов слабых кислот и оснований: где CH – количество продиссоциированных молекул слабойa×(к-ты) кислоты рН = – lg[H+] = – lgCH .a×(к-ты) где CH – количество продиссоциированных молекул слабогоa×(осн.) основания рОН = – lg[ОН–] = – lg CH a×(осн.) рН = 14 – рОН. Интервалы перехода цвета индикаторов[править | править исходный текст] На рисунке приведены ориентировочные данные о существовании разных цветных форм индикаторов в водных растворах.
Поиск по сайту: |
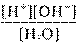 10×= 1,8 -16моль/л
10×= 1,8 -16моль/л =[H+][OH– 10×] = 1,8 -16 55,6 = 10×- 14
=[H+][OH– 10×] = 1,8 -16 55,6 = 10×- 14 называют ионным произведением воды. Эта величина постоянная при данной температуре. С ростом температуры ионное произведение воды увеличивается.
называют ионным произведением воды. Эта величина постоянная при данной температуре. С ростом температуры ионное произведение воды увеличивается.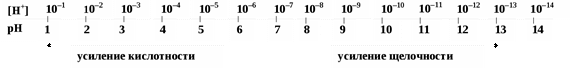
 , [H+] = CH (к-ты)fa,
, [H+] = CH (к-ты)fa, + OH–, [OH–] = CH ,a×(осн.)
+ OH–, [OH–] = CH ,a×(осн.)