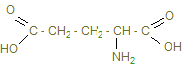|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Обнаружение аспартатаминотрансферазы (АсАТ) в нормальной и патологической в сыворотке крови
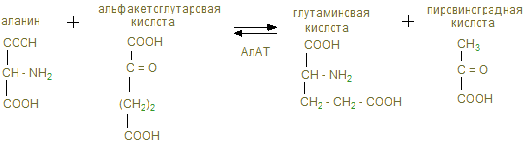
Существуют спектрофотометрические и колориметрические методы определения аминотрансферазы. Колориметрические методы основаны на образовании окрашенного продукта динитрофенилгидразона пировиноградной кислоты, образовавшейся в результате реакции переаминирования. Наиболее диагностическое значение имеет определение в сыворотке крови активности двух аминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ). АлАТ катализирует реакцию:
АсАт катализирует реакцию:
В результате переаминирования под действием АсАТ аспарагиновая кислота превращается в щавелевоуксусную. А аланин под действием АлАТ – в пировиноградную кислоту. Щавелевоуксусная кислота в процессе ферментативной реакции способна превращаться в пировиноградную кислоту, которая с 2,4динитрофинилгидразином образуют окрашенный продукт – динитрофенилгидразон пировиноградной кислоты. Интенсивность окраски последнего пропорциональна к количеству образовавшейся пировиноградной кислоты, и, следовательно активности фермента. Расчет по прилагаемой таблице. Активность аминотрансферазы выражают в микромолях пировиноградной кислоты, образованной в 1 мл сыворотки крови за 1 час инкубации при температуре 37оС. В норме активность аминотрансфераз в сыворотке крови человека невелика и составляет для АсАТ от 0,1 до 0,45 мкмоль/ч, а для АлАТ – 0,1-0,68 мкмоль/ч пировиноградной кислоты на 1 мл сыворотки, но резко возрастает при инфаркте миокарда и вирусном гепатите. Ход работы. Берем 2 пробирки: отмечаем – одна – контроль, вторая опыт. В опытную пробирку наливаем 0,05 мл сыворотки крови и 0,25 мл субстрата АсАТ (содержит аспарагиновую и α-кетоглутаровую кислоты). В контрольную добавляем 0,05 мл дистиллированной воды и 0,25 мл субстрата. Обе пробирки помещаем в термостат на 35 минут. После чего в обе пробирки добавляем 0,25 мл ДНФГ (динитрофенилгидразина), оставляем на 20 минут при комнатной температуре, затем добавляем 2,5 мл гидроксида натрия (0,4N) и фотометрируем: светофильтр зеленый (длина волны 54о нм), кювета 10 против контроля. Расчет проводим по таблице, где дана экстинция и активность.
Диагностическое значение анализа. Реакции переаминирования являются центральным звеном внутриклеточного метаболизма аминокислот и важным звеном связки между обменом белков и углеводов, а в определенной мере и жиров. Процессы переаминирования (трансаминирования) катализируются ферментами – аминотрансферазами (трансаминазами), с участием производного витамина В6 –пиродоксаль-фосфата. В клинической практике широко используется определение активности двух наиболее важных аминотрансфераз: аспартат-аминотрансферазы (АсАТ) и аланинаминотрансферазы (АлАТ) – для ранней диагностики инфаркта миокарда и заболеваний печени, особенно при вирусном гепатите. АлАТ преобладает в печени, а АсАТ – в миокарде. В сыворотке крови здорового человека их активность низкая, но она резко возрастает при поражении печени или миокарда, за счет поступления ферментов в кровь из больного органа. Поэтому определение аминотрансфераз в сыворотке крови имеет важное значение для ранней диагностики поражений печени и миокарда. Вот почему знание биохимической роли процессов переаминирования и диагностического значения определения аминотрансфераз сыворотки крови необходимы будущему врачу. Контрольные вопросы по теме 1. Механизм всасывания аминокислот в кишечнике. 2. Почему внутриклеточный обмен аминокислот наиболее важная фаза обмена? 3. Укажите основные направления внутриклеточного обмена аминокислот. 4. Что такое гниение белков в кишечнике? Напишите формулы продуктов гнилостного разложения следующих аминокислот: а) лизин; б) орнитин; в) тирозин; г) триптофан. 5. Механизм декарбоксилирования аминокислот. 6. Биологическая роль процесса декарбоксилирования аминокислот. 7. Написать реакции образования а) гистамина; б) серотонина; в) гамма-аминомасляной кислоты. Их биологическая роль. 8. Дайте определение процессам переаминирования и его роль в обмене веществ 9. Строение аминотрансфераз (трансаминаз). 10. Приведите примеры реакции внутриклеточного обмена аминокислот. 11. Какие наиболее важные биохимические процессы происходят с аминокислотами при внутриклеточном обмене? 12. Какой механизм ферментативного переаминирования? Аминотрансферазы. 13. Какова роль пиродоксаль-фосфата в процессах переаминирования? 14. Напишите в общем виде схему переаминирования между аспарагиновой кислотой и альфа-кетаглутаровой кислотой. 15. Какое диагностическое значение определения важнейших аминотрансфераз сыворотки крови АлАТ и АсАТ и при каких заболеваниях? 16. Объясните принцип определения аминотрансфераз АлАТ и АсАТ в сыворотке крови. 17. Какое биологическое значение процессов переаминирования. Общие представления о роли переаминирования в обмене веществ. 18. Напишите схему переаминирования между аланином и пиродоксаль-фосфат-ферментом до стадии образования пировиноградной кислоты и пиродоксамин-фосфат-фермена. 19. Напишите схему переаминирования от стадии взаимодействия пиродоксамин-фосфат-фермента с альфа-кетаглутаровлй кислотой до образования глутаминовой кислоты и пиродоксадьфосфат-фермента. 20. Какую роль играют альфа-кетокислоты (альфа-кетоглутаровая, щавелевоуксусная, пировиноградная) в превращениях аминокислот? 21. Что погимают под процессами дезаминирования аминокислот? 22. В чем состоит различие между процессами трансаминирования и дезаминирования аминокислот? 23. Перечислите возможные пути дезаминирования аминокислот и напишите их схематически. Укажите, какой путь дезаминирования аминокислот характерен для организма человека и назовите продукты этой реакции. 24. Какой токсический для организма человека образуется в тканях продукт в результате дезаминирования аминокислот? 25. Какие еще органические вещества, имеющие аминогруппу, кроме аминокислот, могут подвергаться дезаминированию? 26. Укажите, что понимают под непрямым путем дезаминирования аминокислот? Что такое трансдезаминирование? 27. В чем состоит биологическое значение непрямого пути дезаминирования аминокислот? 28. Какие ферменты катализируют реакции окислительного дезаминирования аминокислот? Каково их строение? 29. Напишите схему окислительного дезаминировани глутаминовой кислоты и укажите фермент, катализирующий эту реакцию. Приведите название кофермента. Какую функцию он выполняет? Какие продукты реакции образуются? 30. Какие аминокислоты наиболее активно дезаминируются прямым путем? 31. Напишите уравнение реакции (с указанием фермента) прямого дезаминирования а) аланина, валина; б) лейцина, изолейцина, триптофана, фенилаланина, тирозина, глутаминовой кислоты. 32. Что такое восстановительное аминирование? Укажите биологическое значение этого процесса. 33. Какие аминокислоты образуют при восстановительном аминировании альфа-кетаглутаровой и щавелевоуксусной кислоты? 34. Какие наиболее важные аминокислоты активно участвуют в тканевом обмене? 35. Приведите общую краткую схему моноаминодикарбоновых аминокислот (глутаминовой, аспарагиновой) и образования из них биологически важных соединений. 36. Приведите общую схему обмена серосодержащих аминокислот (метионина, цистеина) и образования из них биологически важных соединений. 37. Роль метионина в азотистом обмене. Напишите реакцию образования активной формы метионина. 38. Что такое реакция трансметилирования? В биосинтезе каких веществ имеет место эта реакция? 39. Напишите реакции синтеза креатина. Какова роль биологическая этого вещества? 40. Напишите уравнение реакции, катализирующуюся креатинфосфокиназой. Диагностическое значение определения активности креатинфосфокиназы. 41. Напишите формулу конечного продукта обмена креатина. Диагностическое значение определения креатина в крови и моче. 42. Напишите реакции образования таурина. Какова его роль в организме? 43. Приведите общую схему обмена ароматических аминокислот (фенилаланина и тирозина) и образования в них биологически важных соединений. 44. Основные пути обмена фенилаланина и тирозина (представить в виде схемы). 45. Наследственные нарушения обмена фенилаланина и тирозина. 46. Приведите общую схему обмена гетероциклических аминокислот (триптофана, гистидина) и образования из них биологически важных соединений. 47. Какие соединения образуются из данной аминокислоты в результате ее декарбоксилирования?
48. Какие соединения образуются из данной аминокислоты в результате ее дкарбоксилирования?
Поиск по сайту: |