 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Рівняння стану ідеального газу. Рівняння стану ідеального газу - це рівняння, що поєднує параметри стану цього газу - p
Рівняння стану ідеального газу - це рівняння, що поєднує параметри стану цього газу - p, V, T. Його виводять з основного рівняння МКТ у вигляді
Добуток сталої Авогадро NA на сталу Больцмана k є сталою величиною, яку позначають як R = NAk. Числове значення універсальної газової сталої Остаточно знаходимо рівняння, яке містить тільки макроскопічні характеристики газу і є наслідком основного рівняння МКТ газів. Це рівняння називають рівнянням стану ідеального газу або рівнянням Клапейрона-Менделеєва:
Для 1 моля ідеального газу рівняння набуде вигляду pVm = RT. Для довільної кількості ν молів молекул газу : pV = νRT. Газ сталої маси може перебувати в різних станах з різними параметрами:
Праві частини обох виразів однакові. Порівнюючи їх ліві частини, отримаємо рівняння, справедливе для газу незмінної маси: Рівняння (3.1.16) називають рівнянням Клапейрона (об'єднаним газовим законом). Рівняння стану дозволяє визначити: - одну з макроскопічних величин (p, V, T), знаючи дві інші; - перебіг процесів у системі; - зміну стану системи під час виконання нею роботи або отримання теплоти від тіл, які її оточують. Експериментально підтвердити рівняння стану у вигляді Лише при тисках у сотні атмосфер відхилення від результатів розрахунків за рівнянням стану ідеального газу стають суттєвими. Ізопроцеси в газах. За допомогою рівняння стану ідеального газу можна досліджувати процеси, в яких маса газу і один із трьох параметрів залишаються незмінними. Процес - це перехід системи з одного стану в другий. Кількісні залежності між двома параметрами газу за фіксованого значення третього параметра називають газовим законом. Процеси, які відбуваються за незмінного значення одного з параметрів ідеального газу сталої маси m і певного сорту μ називають ізопроцесами. Оскільки жоден із параметрів газу не може бути строго фіксованим, то ізопроцес - це ідеалізована модель стану ідеального газу. Розглянемо такі ізопроцеси. 1. Ізотермічний процес (m = const, μ = const, T = const). Якщо до ізотермічного процесу застосувати рівняння стану у вигляді (3.1.16), то з урахуванням сталості температури T1 = T2 воно набуде вигляду p1V1 = p 2V2, pV = const, (3.1.17) і тому закон Бойля - Маріотта можна сформулювати так: для деякої маси газу добуток тиску газу на об'єм заT= const є сталою величиною. Цей закон справедливий для будь-яких газів, які можна вважати ідеальними, а також для їх сумішей. Графічно залежність тиску газу від об'єму при умові T = const можна зобразити у вигляді кривої - ізотерми в координатах p, V і прямих ліній в координатах p, T та V, T (рис.3.1.13 а, б, в).
Ізотермічним можна вважати процес стиснення повітря компресором, або розширення під поршнем насоса газу внаслідок відкачування його з посудини. 2. Ізобарний процес (m = const, μ = const, T = const).
Графік залежності об'єму від температури за сталого тиску є прямою лінією, яку називають ізобарою. На рис.3.1.14 а зображено дві ізобари в координатах V, T за різних значень тиску p1 і p2, причому p1<p2. На рис.3.1.14 б, в наведено графіки ізобарного процесу в координатах p, T, p, V.
3. Ізохорний процес (m = const, μ = const, T = const).
Графіком залежності тиску від температури за сталого об'єму є пряма лінія, яку називають ізохорою. На рис. 3.1.15 а в координатах p, T зображено дві ізохори за різних значень об'єму V1 і V2, причому V1<V2. На рис. 3.1.15 б, в наведено графіки процесу в координатах V, T і p, V.
Газові закони і їх графічні ілюстрації дозволяють вивчати довільні термодинамічні процеси з ідеальним газом, наприклад, як встановити нагрівається чи охолоджується газ під час переходу з стану 1 у стан 2 (рис.3.1.16). Для того, щоб це визначити, проводять декілька ізотерм. Газ охолоджується, бо ізотерма T3 знаходиться нижче ізотерми T1.
Газ подібний до пружини, яка завжди стиснутий. Тиск газу можна змінювати, змінюючи його об'єм або температуру. Крім того, тиск газу залежить від його маси. Збільшуючи масу газу в будь-якому замкненому об'ємі, можна підвищити тиск. Так роблять, накачуючи повітрям автомобільну шину або футбольний м'яч. Гази порівняно з рідинами і твердими тілами легко стискуються. Велика стисливість газів дає змогу запасати їх у великих кількостях у балонах, зручних для зберігання. Стиснутий природний газ транспортують по трубах на відстані в тисячі кілометрів. Тиск і об'єм газів значно збільшуються з підвищенням температури. Велика стисливість і легкість, можливість регулювання тиску - усе це робить газ одним із найдосконаліших амортизаторів, який застосовують в багатьох пристроях. Газ - робоче тіло теплових двигунів. Запитання для самоперевірки 1. Наведіть рівняння стану системи. 2. Виведіть рівняння Менделєєва-Клапейрона для довільної маси ідеального газу. 3. Чому дорівнює універсальна газова стала в СІ? 4. Як записати рівняння стану для одного моля ідеального газу? 5. Виведіть рівняння стану ідеального газу Клапейрона. Як воно формулюється? 6. Чому дорівнює об'єм одного моля будь-якого газу за нормальних умов? 7. Який фізичний зміст універсальної газової сталої? 8. Що таке параметри стану системи? Які величини до них належать? 9. Що таке ізопроцеси? 10. Який процес називають ізотермічним? Яким законом описується цей процес? Як формулюють і записують цей закон? Зобразіть і поясніть графіки цього закону. 11. Який процес називають ізохорним? Яким законом описують ізохорний процес? Як формулюють і записують цей закон? Зобразіть і поясніть графік цього закону. 12. Який процес називають ізобарним? Яким законом описують ізобарний процес? Як формулюють і записують цей закон? Зобразіть і поясніть графік цього закону.
Поиск по сайту: |

 ; R - це фундаментальна фізична стала, яка чисельно дорівнює роботі ізобарного розширення одного моля ідеального газу під час його нагрівання на 1 К.
; R - це фундаментальна фізична стала, яка чисельно дорівнює роботі ізобарного розширення одного моля ідеального газу під час його нагрівання на 1 К.

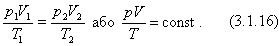
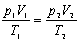 можна за допомогою сильфона - тіла змінного об'єму.
можна за допомогою сильфона - тіла змінного об'єму.
 - закон Гей-Люссака, де V = const·T .
- закон Гей-Люссака, де V = const·T .
 ; p = const·T
; p = const·T
 Гази мають низку властивостей, завдяки яким вони незамінні в багатьох технічних установках.
Гази мають низку властивостей, завдяки яким вони незамінні в багатьох технічних установках.