 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Адсорбція газів на твердих поверхнях. Рівняння Фрейндліха
Лекція № 6 Адсорбція газів твердими тілами 1. Особливості адсорбції на твердих тілах 2. Адсорбція газів на твердих поверхнях. Рівняння Фрейндліха 3. Полімолекулярна адсорбція
Особливості адсорбції на твердих тілах Адсорбція на поверхні твердих тіл має такі особливості: 1. Поверхня неоднорідна; 2. Адсорбція відбувається не на всій поверхні, а тільки на активних центрах, тому адсорбція є локалізованною; 3. Адсорбція є оборотним процесом: поряд з адсорбцією відбувається десорбція. Час життя молекули в адсорбційному стані малий, але за цей час встигає пройти теплообмін між газом та адсорбентом. Таким шляхом прогрівається повітря від нагрітих сонцем грунту та води, що має надзвичайно велике значення для життя на Землі. 4. Поряд з адсорбцією можлива хемосорбція. Наприклад, на поверхні металу при адсорбції кисню утворюються оксиди: 4Al + 3O2 → 2Al2O3. 5. Поряд з адсобцією часто відбувається абсорбція. Стан поверхні сорбенту є визначаючим в цьому виді адсорбції. Всі адсорбенти поділяються на дві великі групи: сорбенти з гладкою поверхнею (непористі) та пористі сорбенти. Пористі мають значно більшу питому площу. До непористих сорбентів відносяться оксиди металів та неметалів (Al2O3, SiO2, біла сажа, аеросили – спеціально модифіковані види SiO2), солі (ZnSO4, BaSО4), графітована сажа. Адсорбція залежіть від спорідненості адсорбента до абсорбата. Ця спорідненість тим вище, чим більше виражена схильність до утворення певних зв’язків. Наприклад, сажа неполярна, тому на неї добре сорбуються неполярні органічні сполуки. На іонних кристалах, які мають на поверхні полярні гідроксильні групи добре сорбуються полярні речовини – вода, спирти, аміни тощо. Адсорбція залежіть від ступені дисперсності – чим менше розмір частин, тим більша їх загальна площа. Промисловість випускає велику кількість таких матеріалів (наприклад, аеросили мають розмір частин порядку 10–6 см). Як адсорбенти вони використовуються рідко, тому що легко вспилюються й частіше використовуються як наповнювачі полімерів, лаків та мастил. Пористими тілами є тверді тіла, які мають внутрішні пори, що зумовлюють наявність внутрішньої міжфазної поверхні. Адсорбція на пористих тілах залежіть від спорідненості адсорбента та адсорбтива, розмірів та кількості пор. В залежності від розміру пор асорбенти поділяють на макропористі (r = 100÷200 нм), капілярно-пористі (r = 0,5÷100 нм), мікропористі (розміри пор того ж порядку, що й розміри адсорбованих молекул). До капілярно-пористих відносять силікагелі, алюмогелі, алюмосилікагелі, до мікропористих – цеоліти та вуглі (вуглі добувають з кам’яного вугілля, торфу, дерев, тваринних кісток, найкращі добуваються з кокосових або абрикосових кісточок). Один грам активованого вугілля має поверхню від 500 до 1000 м2! Цеолітами є природні та синтетичні алюмосилікати, які мають трубчасті пори строго відповідного діаметру, які здатні поглинати певні речовини з сумішей. Ще їх називають молекулярними ситами. Поруватістю (П) називають відношення об’єму пор до загального об’єму тіла, тобто поруватість визначає частку пустот в структурі тіла. Вона залежіть від питомої поверхні адсорбенту – чим вона вище, тим більше емність адсорбенту.
Адсорбція газів на твердих поверхнях. Рівняння Фрейндліха Величина адсорбції газу залежіть від природи сорбенту та газу, концентрації газу (пари), температури. Капілярна конденсація Капілярною конденсацією називається процес конденсації пари речовин в пористих твердих тілах (пара речовин відрізняється від газового стану тим, що знаходиться при тиску, близькому до тиску насиченої пари і температурі, близький до температури кипіння рідини, з якої отриманий пар). Капілярна конденсація − це перший етап адсорбції пари на твердій поверхні. За умов змочування зрідженою парою стінок капілярів в порах, пара конденсується при тисках Р, менших, ніж тиск насиченої пари над площинними поверхнями рідини при тій самій температурі − Рs. При цьому утворюються угнуті меніски. Якщо спостерігається явище незмочування, то навпаки − тиск конденсації більший, чим тиск насиченої пари над розчином й конденсація не відбувається. Кількість утриманої капілярними силами рідини залежіть від радіуса кривизни поверхні визначається Капілярну конденсацію використовують для вловлювання пари пористими сорбентами, в процесах сушки, удержування вологи грунтами, будівельними та ін. матеріалами. Залежність адсорбції від властивостей газу
Рис. 1. Ізотерма адсорбції для газів при Т1 і Т2 (Т1 >Т2) Залежність адсорбції газу від його концентрації (t = const) має складний характер. Форма ізотерми ад-сорбції (рис. 1) на твердих тілах залежить від властивостей адсорбента та адсорбата, взаємодії адсорбент-адсорбат, взаємодії молекул адсорбата між собою в газовій фазі та в адсорбованому стані. В області малих тисків (концентрацій) взаємодія між молекулами адсорбата незначна, і залежність описується законом Генрі: величина адсорбції газа прямо пропорційна тиску. Г = kP; Г= kC ( Р – тиск, С – концентрація).
Горизонтальна ділянка показує, що при великих тисках адсорбція практично не залежіть від диску. Проміжна ділянка ІІ описується емпіричним рівнянням Фрейндліха Г = bP1/n, або Г = bС1/n де b та 1/n константи, що залежать тільки від природи газу. Це рівняння параболи. Для знаходження констант його логарифмують. При логарифмуванні рівняння Фрейндліха переходить у лінійну форму lgГ = lgb + 1/nlgP(С) і в координатах lg Г – lgР ізотерма має вид прямої. Константи знаходяться аналогічно константам в рівнянні Ленгмюра: Z − відрізок, який відсікає пряма на вісі ординат, 1/n = tg b − тангенсу кута нахилу прямої до вісі х. Рис. 2. Графік для визначення констант рівняння адсорбції Фрейндліха; Ізотерма адсорбції в логаріфмічних координатах
Приклад 4. Побудувати ізотерму адсорбції СО2 активованим вугіллям при 231 К і визначити константи емпіричного рівняння Фрейндліха, використовуючи такі експериментальні дані: [Р] ×102, Па 10,0 44,8 100,0 144,0 250,0 452 Г, моль/кг 0,734 1,516 2,186 2,664 3,295 4,023. Розв’язання: Рівняння Фрейндліха: Г = bР1/n, де b і п − сталі величини, характерні для процесу адсорбції; Р − рівноважний тиск газу, Па. В логаріфмічній формі lgГ = lgb+ 1/п lgР, графік є прямою. Знаходимо логарифми рівноважних тисків і відповідних величин адсорбції і будуємо графік ізотерми адсорбції. [Р] 0,10 0,448 1,00 1,44 2,50 4,52 Г 0,734 1,516 2,186 2,664 3,295 4,023; lg[Р] −1,0; −0,35; 0,0; 0,16; 0,40; 0,65; lgГ −0,16; 0,18; 0,34; 0,43; 0,52; 0,60.
За рисунком знаходимо lgb= 0,35, b = 2,2; 1/п = tgj = ВС/AC = 0,62:1,5 = 0,42. Відповідь: b = 2,2; 1/п = 0,42. Для визначення адсорбції на твердих сорбентах можна також використовувати рівняння Ленгмюра (якщо відбувається мономолекулярна адсорбція), в якому концентрації адсорбованої речовини замінені на рівноважні тиски.
Поиск по сайту: |
 Адсорбція газу залежіть від його природи − він повинен мати певну спорідненість до адсорбенту. Газ адсорбується тим краще, чим легше зріджується, чим вище його критична температура та температура конденсації.
Адсорбція газу залежіть від його природи − він повинен мати певну спорідненість до адсорбенту. Газ адсорбується тим краще, чим легше зріджується, чим вище його критична температура та температура конденсації. Коефіцієнт пропорційності (коефіцієнт Генрі) k є мірою інтенсивності адсорбції.
Коефіцієнт пропорційності (коефіцієнт Генрі) k є мірою інтенсивності адсорбції.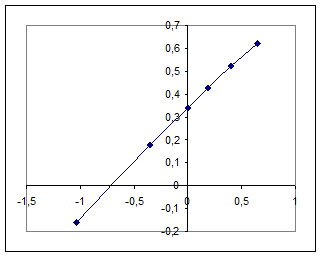 Рис. 3. Логаріфмічна ізотерма адсорбції
Рис. 3. Логаріфмічна ізотерма адсорбції