 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ФОТОХИМИЧЕСКИЕ РЕАКЦИИСтр 1 из 3Следующая ⇒
Сложные реакции Сложными называют химические реакции, протекающие более чем в одну стадию. Рассмотрим в качестве примера одну из сложных реакций, кинетика и механизм которой хорошо изучены: 2НI + Н2О2 ––> I2 + 2Н2О Данная реакция является реакцией второго порядка; её кинетическое уравнение имеет следующий вид:
Изучение механизма реакции показало, что она является двухстадийной (протекает в две стадии): 1) НI + Н2О2 ––> НIО + Н2О 2) НIО + НI ––> I2 + Н2О Скорость первой стадии V1 много больше скорости второй стадии V2 и общая скорость реакции определяется скоростью более медленной стадии, называемой поэтому скоростьопределяющей или лимитирующей. Сделать вывод о том, является реакция элементарной или сложной, можно на основании результатов изучения её кинетики. Реакция является сложной, если экспериментально определенные частные порядки реакции не совпадают с коэффициентами при исходных веществах в стехиометрическом уравнении реакции; частные порядки сложной реакции могут быть дробными либо отрицательными, в кинетическое уравнение сложной реакции могут входить концентрации не только исходных веществ, но и продуктов реакции. Классификация сложных реакций Последовательные реакции. Последовательными называются сложные реакции, протекающие таким образом, что вещества, образующиеся в результате одной стадии (т.е. продукты этой стадии), являются исходными веществами для другой стадии. Схематически последовательную реакцию можно изобразить следующим образом: А ––> В ––> С ––> ... Число стадий и веществ, принимающих участие в каждой из стадий, может быть различным. Параллельные реакции. Параллельными называют химические реакции, в которых одни и те же исходные вещества одновременно могут образовывать различные продукты реакции, например, два или более изомера:
Сопряженные реакции. Сопряженными принято называть сложные реакции, протекающие следующим образом: 1) А + В ––> С 2) А + D ––> Е, причем одна из реакций может протекать самостоятельно, а вторая возможна только при наличии первой. Вещество А, общее для обеих реакций, носит название актор, вещество В – индуктор, вещество D, взаимодействующее с А только при наличии первой реакции – акцептор. Например, бензол в водном растворе не окисляется пероксидом водорода, но при добавлении солей Fe(II) происходит превращение его в фенол и дифенил. Механизм реакции следующий. На первой стадии образуются свободные радикалы: Fe2+ + H2O2 ––> Fe3+ + OH– + OH• которые реагируют с ионами Fe2+ и бензолом: Fe2+ + OH• ––> Fe3+ + OH– C6H6 + OH• ––> C6H5• + H2O Происходит также рекомбинация радикалов: C6H5• + OH• ––> C6H5ОН C6H5• + C6H5• ––> C6H5–C6H5 Т.о., обе реакции протекают с участием общего промежуточного свободного радикала OH•. Цепные реакции. Цепными называют реакции, состоящие из ряда взаимосвязанных стадий, когда частицы, образующиеся в результате каждой стадии, генерируют последующие стадии. Как правило, цепные реакции протекают с участием свободных радикалов. Для всех цепных реакций характерны три типичные стадии, которые мы рассмотрим на примере фотохимической реакции образования хлороводорода. 1. Зарождение цепи (инициация): Сl2 + hν ––> 2 Сl• 2. Развитие цепи: Н2 + Сl• ––> НСl + Н• Н• + Сl2 ––> НСl + Сl• Стадия развития цепи характеризуется числом молекул продукта реакции, приходящихся на одну активную частицу – длиной цепи. 3. Обрыв цепи (рекомбинация): Н• + Н• ––> Н2 Сl• + Сl• ––> Сl2 Н• + Сl• ––> НСl Обрыв цепи возможен также при взаимодействии активных частиц с материалом стенки сосуда, в котором проводится реакция, поэтому скорость цепных реакций может зависеть от материала и даже от формы реакционного сосуда. Реакция образования хлороводорода является примером неразветвленной цепной реакции – реакции, в которой на одну прореагировавшую активную частицу приходится не более одной вновь возникающей. Разветвленными называют цепные реакции, в которых на каждую прореагировавшую активную частицу приходится более одной вновь возникающей, т.е. число активных частиц в ходе реакции постоянно возрастает. Примером разветвленной цепной реакции является реакция взаимодействия водорода с кислородом: 1. Инициация: Н2 + О2 ––> Н2О + О• 2. Развитие цепи: О• + Н2 ––> Н• + ОН• Н• + О2 ––> О• + ОН• ОН• + Н2 ––> Н2О + Н• ФОТОХИМИЧЕСКИЕ РЕАКЦИИ Передача энергии для активации вступающих во взаимодействие молекул может осуществляться либо в форме теплоты (т. н. темновые реакции), либо в виде квантов электромагнитного излучения. Реакции, в которых активация частиц является результатом их взаимодействия с квантами электромагнитного излучения видимой области спектра, называют фотохимическими реакциями. При всех фотохимических процессах выполняется закон Гротгуса: Химическое превращение вещества может вызвать только то излучение, которое поглощается этим веществом. Взаимодействие света с веществом может идти по трем возможным направлениям: 1. Возбуждение частиц (переход электронов на вышележащие орбитали): A + hν ––> A* 2. Ионизация частиц за счет отрыва электронов: A + hν ––> A+ + e– 3. Диссоциация молекул с образованием свободных радикалов (гомолитическая) либо ионов (гетеролитическая): AB + hν ––> A• + B• AB + hν ––> A+ + B– Между количеством лучистой энергии, поглощенной молекулами вещества, и количеством фотохимически прореагировавших молекул существует соотношение, выражаемое законом фотохимической эквивалентности Штарка-Эйнштейна: Число молекул, подвергшихся первичному фотохимическому превращению, равно числу поглощенных веществом квантов электромагнитного излучения. Поскольку фотохимическая реакция, как правило, включает в себя и т.н. вторичные процессы (например, в случае цепного механизма), для описания реакции вводится понятие квантовый выход фотохимической реакции: Квантовый выход фотохимической реакции γ есть отношение числа частиц, претерпевших превращение, к числу поглощенных веществом квантов света. Квантовый выход реакции может варьироваться в очень широких пределах: от 10-3 (фотохимическое разложение метилбромида) до 106 (цепная реакция водорода с хлором); в общем случае, чем более долгоживущей является активная частица, тем с большим квантовым выходом протекает фотохимическая реакция. Важнейшими фотохимическими реакциями являются реакции фотосинтеза, протекающие в растениях с участием хлорофилла. Процесс фотосинтеза составляют две стадии: световая, связанная с поглощением фотонов, и значительно более медленная темновая, представляющая собой ряд химических превращений, осуществляемых в отсутствие света. Суммарный процесс фотосинтеза заключается в окислении воды до кислорода и восстановлении диоксида углерода до углеводов: СО2 + Н2О + hν ––> (СН2О) + О2, ΔG° = 477.0 кДж/моль Протекание данного окислительно-восстановительного процесса (связанного с переносом электронов) возможно благодаря наличию в реакционном центре хлорофилла Сhl донора D и акцептора A электронов; перенос электронов происходит в результате фотовозбуждения молекулы хлорофилла: DChlA + hν ––> DChl*A ––> DChl+A– ––> D+ChlA– Возникающие в данном процессе заряженные частицы D+ и A– принимают участие в дальнейших окислительно-восстановительных реакциях темновой стадии фотосинтеза
Поиск по сайту: |
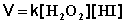 (II.28)
(II.28)