 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ РЕАКЦИЙ ⇐ ПредыдущаяСтр 3 из 3
Правило Вант-Гоффа:в области невысоких температур (0÷300) 0 С при увеличении температуры на 100 скорость реакции возрастает в 2 – 4 раз γ = (2-4) - температурный коэффициент показывает, во сколько раз увеличивается скорость при повышении температуры на 100
DrН<0
Т Аррениус: К реакции приводит столкновение лишь активных молекул, энергия которых больше определённой величины энергии Ea ,необходимой для ослабления и перестройки связей, т.е. для перехода веществ в состояние активированного комплекса Активированный комплекс – переходное состояние системы (старые связи ослабли, новые не сформировались), для его образования необходима энергия Еа Для реакции: АВ + ДС → АД + ВС
Д – С Д….С В - С исходные активированный продукты молекулы комплекс реакции
Для обратимой реакции АВ + ДС = АД + ВС (Еаэкз ˂ Еаэнд): ∆rHпр = Hкон. – Hнач = Еапр - Еаобр Þ связь термодинамических и кинетических параметров Величина Еа отражает влияние природы исходных частиц на скорость реакции (чем прочнее связи, тем труднее их разорвать, тем больше Еа и меньше скорость). Определяют на основании значений Есвязей. Еа большинства реакций (40 ÷400) кДж/моль. Доля активных частиц растет под действием: тепловой, световой, электрической энергий, рентген. лучей и др. При увеличении Т число активных частиц ↑ и скорость ↑
Уравнение С.Аррениуса k – константа скорости реакции при Т k0 – предэкспоненциальный множитель, не зависит от Т k0 = k, если Еа = 0 Физич. смысл k0 - частотно-ориентационный фактор, учитывающий влияние числа столкновений (z) и ориентации молекул (Poр.) на скорость k0 = z Poр Для осуществления реакции необходима благоприятная ориентация молекул в момент столкновения.
Неблагоприятная ориентация благоприятная ориентация Реакция принципиально возможна при достижении исходными частицами Е>Ea и их надлежащей ориентации (Т=const). Из уравнения Аррениуса Из преобразования уравнений Аррениуса для двух Т можно определить Еа (аналитический способ):
и при ∆Т=10 lgγ = (Еа./2,3R)(1/T1–1/T2)
Другой способ - графический: строят график зависимости в координатах (lgk, 1/T).
lgk0 tg a=
a 1/T Задача 4. Рассчитайте изменение константы скорости реакции, имеющей энергию активации 191 кДж/моль, при увеличении температуры от 330 до 400К. Решение. Уравнение Аррениуса
где R = 8,31 Дж/(моль×К) – универсальняая газовая постоянная.
Следовательно
Задача 5. Определите константу скорости реакции 2НI(г) ® Н2(г) + I2(г) при температуре 2000 С , если предэкспоненциальный множитель A0 = 9,2·1013, а энергия активации ЕА = 186,4 кДж/моль. Каков физический смысл константы скорости реакции? От каких параметров и как зависит константа скорости реакции? Укажите ее размерность для Вашей реакции (порядок реакции n =2) Решение. Уравнение С.Аррениуса k – константа скорости реакции при данной Т, размерность А0 – предэкспоненциальный множитель, не зависит от Т А0 = k, если Еа = 0 Физич. смысл А0 - частотно-ориентационный фактор, учитывающий влияние числа столкновений (z) и ориентации молекул (Poр.) на скорость А0 = z Poр Для осуществления реакции необходима благоприятная ориентация молекул в момент столкновения. Уравнение, связывающее скорость реакции с концентрацией исходных веществ, называют кинетическим. Для n=2 основное кинетическое уравнение k - константа скорости: а) не зависит от концентрации б) зависит от температуры, природы реагирующих веществ, катализатора, площади поверхности раздела фаз. Физический смысл константы скорости: k – удельная скорость: n = 2 общий порядок реакции В простых реакциях: n = 1, 2 редко 3 и общий порядок равен молекулярости. Размерность k зависит от порядка реакции. Для n =2 [k ]= л/(моль×с). При Т=273 +200=473 К k = 9,2·1013 . exp(-186400/8,31. 473) = 9,2·1013 e-46= 9,2·10-7 л/(моль×с).
Поиск по сайту: |
 или
или  при С = const (для приблизительных расчётов)
при С = const (для приблизительных расчётов) gэкзотерм.< gэндотерм. J DrН>0
gэкзотерм.< gэндотерм. J DrН>0

 +
+
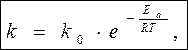

 или
или 
 (Еа./R)(1/T1–1/T2) или lgγ = (Еа./2,3R)(10/T1T2)
(Еа./R)(1/T1–1/T2) или lgγ = (Еа./2,3R)(10/T1T2) lgk
lgk


 Логарифм отношения констант скоростей реакции при температурах Т2 и Т1
Логарифм отношения констант скоростей реакции при температурах Т2 и Т1



 , если С= 1моль/л
, если С= 1моль/л