 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Уравнения, связывающие концентрацию исходных веществ и время
(Т = const) Реакции 1-ого порядка А ® В CH3OCH3® CH4 + H2 + CO Кинетическое уравнение реакции первого порядка:
С0 – исходная концентрация, С - концентрация в момент времени t
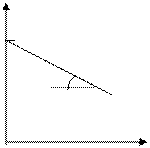
lgCo
t, с период полупревращения τ1/2:время, за которое прореагировала половина исходного количества вещества C = 0,5C0 Þ Реакции 2-ого порядка A + B → продукты или 2А ® продукты
C a tga = k 1/C0 t Период полупревращения для реакций 2-ого порядка C = ½ C0
Реакции 0-го – порядка:С = С0 - kt; t1/2 = С0 /2k, [k]= [моль л-1 с-1] Реакции 3-его порядка: Задача 2. В реакции второго порядка А + В ® D за 1 час концентрации веществ А и В уменьшились по сравнению с начальной с0 А = с0 В = 0,2 моль/л на 30 %. Определите константу скорости и скорость реакции в начальный момент времени и через час после начала реакции. Решение. Концентрации веществ А и В за 1 час уменьшились на 0,3×с0 = 0,06моль/л. Отсюда, через час концентрации составят сА = сВ = 0,2 – 0,06 = 0,14(моль/л).
Отсюда
Задача 3. Во сколько раз изменится скорость реакции 2СО(г) + О2(г) ® 2СО2(г) при увеличении давления в системе в 10 раз? Температура системы поддерживается постоянной. Решение. Предположим, что рассматриваемая реакция является элементарной, т. е. для нее справедлив закон действующих масс: υ = k×с2(СО)×с(О2).
Rонцентрация и парциальное давление связаны прямо пропорциональной зависимостью рi = сi×RT, получим, что υ= k×р2(СО)×р(О2). После увеличения давления в системе в 10 раз парциальное давление каждого из реагентов реагентов возрастет тоже в 10 раз, Отсюда υ¢/υ = 1000. Следовательно, скорость реакции увеличится в 1000 раз. Методы определения порядка реакции Экспериментально измеряют Среагир.веществ = f (t) Полученные данные: 1) подставляют в константу скорости реакций 1, 2 и т.д. порядков. Критерий - постоянство k. 2) строят графики: а) если реакция 1-ого порядка Þ график зависимости в координатах (lg C, t) - прямая линия, б) если реакция 2-ого порядка Þ график в координатах (1/C , t) Þ прямая линия.
Задача 4. При изучении кинетики термического разложения ацетона, являющегося реакцией первого порядка, в соответствии с уравнением: СН3СОСН3(г) ® С2Н4(г) + СО(г) + Н2(г) получены следующие экспериментальные данные при Т = 802 К: давление в реакторе изменилось от начального р0 = 312 мм. рт. ст. до 408 мм. рт. ст. за 390 с. Рассчитайте константу скорости реакции. Решение. Все вещества в системе находятся в газообразном состоянии, и, учитывая условия проведения опыта, предполагаем, что они подчиняются законам идеальных газов. Следовательно, концентрация и парциальное давление газа связаны зависимостью pi=ci×R×T или
Отсюда, для реакции I-го порядка и
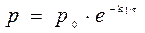
Если р0 – это начальное давление ацетона в реакционном сосуде, то для решения задачи необходимо определить парциальное давление этого вещества к моменту времени, когда общее давление составило 408 м рт.ст.
Из стехиометрии реакции видно, что 1 моль ацетона, распадаясь, образует 3 моль газа. Из закона Авогадро следует, что при уменьшении парциального давления ацетона на Dр сумма парциальных давлений образовавшихся газов составит 3Dр. Таким образом, можно записать P = p0 – Dp + 3×Dp Или 408 = 312 + 2×Dp, Dp = 48 мм рт.ст. Следовательно, парциальное давление ацетона через 390 с после начала опыта составило 312 – 48 = 264 (мм. рт. ст.).
После подстановки в уравнение получим:
Задача 5. При исследовании кинетики реакции распада диметилового эфира были получены следующие данные:
Начальное давление диметилового эфира 4,16×104 Па. Рассчитайте порядок реакции и константу скорости распада диметилового эфира. Решение. Предположим, что реакция имеет первый порядок:
Вместо концентраций используем давления, тогда получим
Подставляя соответствующие значения изменения давления со временем в полученное уравнение, рассчитаем константу скорости:
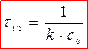
Константа скорости постоянна в пределах погрешности эксперимента, следовательно, предположение, что реакция является реакцией I-го порядка, верно. Отсюда kср = 4,36×10-4 с-1. Задача 6. При температуре 100°С константа скорости реакции второго порядка 2НI(г) ® Н2(г) + I2(г) равна 8,83×10-16 л/(моль×с). Определите время полупревращения йодистого водорода, если начальная концентрация его равна 1 моль/л. Совпадают ли молекулярность и порядок реакции? Напишите основное кинетическое уравнение для реакции. Решение. Простые (элементарные) реакции протекают в одну стадию. Сложные – суммарный результат протекания нескольких простых реакций Простые реакции классифицируют по молекулярности. Молекулярность - число молекул, участвующих в элементарном химическом акте, целое число: 1,2, реже 3. Порядки реакции по веществам определяются экспериментально. В простых реакциях: n = 1, 2 редко 3 и общий порядок равен молекулярости, т.е. порядки реакции по веществам равны стехиометрическим коэициентам. Т.к. по условию порядок реакции n = 2 и он совпадает со стехиометрическим коэффициентом перед исходным веществом в реакции НI, то реакция 2НI(г) ® Н2(г) + I2(г) элементарная, молекулярность и порядок реакции совпадают: реакция бимолекулярная, порядок n = 2, основное кинетическое уравнение: Период полупревращения τ1/2: время, за которое прореагировала половина исходного количества вещества
Для реакции второго порядка
период полупревращения обратно пропорционален начальной концентрации (чем больше С0, тем τ1/2 меньше). Задача 4. Для реакции первого порядка А ® 2В определите время, за которое прореагирует 90 % вещества А. Константа скорости реакции k1 = 10-4 с-1. Решение. После превращения 90 % вещества А его концентрация составит 10% от начальной концентрации, т. е. С = 0,1 с0. Основное кинетическое уравнение Кинетическое уравнение реакции первого порядка: Решение кинетического уравнения lnC = lnC0 - kt где С0 – исходная концентрация; С - концентрация в момент времени t
Время, за которое прореагирует 90% вещества τ =( 1/10-4)ln(C0/0,1C0) = 23026 с = 6,4 ч. Задача 3. В реакции А ® В + С с общим порядком, равным единице, константа скорости k1 = 5×10-5 с-1. Определите концентрацию веществ А и В и скорость реакции через 1 час и через 5 часов, если начальная концентрация А составляла 0,2 моль/л.
Решение. Для реакции 1-го порядка справедливо уравнение где с – текущая концентрация вещества в момент времени τ, с0 – начальная концентрация, k – константа скорости, τ – время.
Через 1 час
Таблица материального баланса
Концентрация вещества В находится по стехиометрическому соотношению веществ А и В. Из уравнения реакции следует, что концентрация вещества В возрастает на ту же величину, на какую убывает концентрация А, т. к. из 1 моль А получается 1 моль В.
Рассчитаем скорость реакции по уравнению:
- через 5 часов
lgCo
tga = k t, с
Поиск по сайту: |
 .
.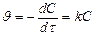 , lnC – lnC0 = -kt Þ lnC = lnC0 - kt
, lnC – lnC0 = -kt Þ lnC = lnC0 - kt


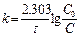 [ k] =[с-1]Для реакций 1-ого порядка зависимость lgC от t линейная:
[ k] =[с-1]Для реакций 1-ого порядка зависимость lgC от t линейная: lgC
lgC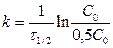
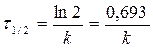 -не зависит от Со для n=1
-не зависит от Со для n=1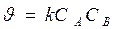 если C0A = C0B
если C0A = C0B
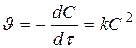
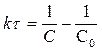
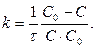 [л×моль-1×с-1]
[л×моль-1×с-1]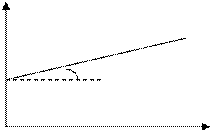 Для реакции 2-ого порядка зависимость 1/С от t линейная
Для реакции 2-ого порядка зависимость 1/С от t линейная

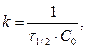 t ½ - обратно пропорционально начальной С0
t ½ - обратно пропорционально начальной С0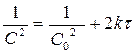 ;
; 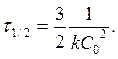 [k]= [моль-2 л2 с-1]
[k]= [моль-2 л2 с-1]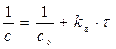 Для реакции II-го порядка
Для реакции II-го порядка
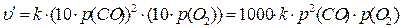
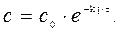
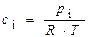
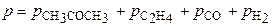 = 408
= 408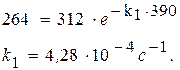
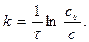
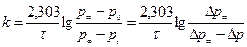
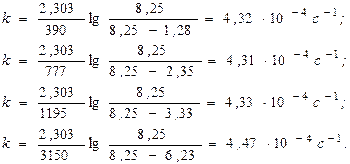
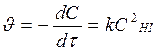 . (В простых реакциях порядки реакции по веществам равны стехиометрическим коэффициентам Þ
. (В простых реакциях порядки реакции по веществам равны стехиометрическим коэффициентам Þ  закон действующих масс для химической кинетики)
закон действующих масс для химической кинетики)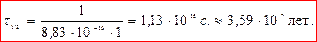
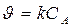 .
. 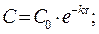
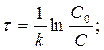
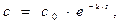
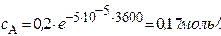
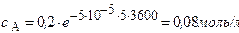 Через 5 часов
Через 5 часов Поэтому через 1 час
Поэтому через 1 час 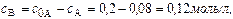 Через 5 часов
Через 5 часов 
 Через 1 час
Через 1 час
 lgC
lgC