 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Влияние концентрации на скорость реакцииСтр 1 из 3Следующая ⇒
Консультация по теме «Химическая кинетика»
ХИМИЧЕСКАЯ КИНЕТИКА изучает скорость, механизм протекания процесса и факторы, влияющие на скорость. Скорость реакции - количество вещества, образующееся в единице реакционного объёма (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции) в единицу времени Гомогенная реакция протекает в гомогенной системе, гетерогенная – на границе раздела фаз.
V– объём реакционной зоны; S-поверхность раздела фаз; τ-время; ni– количество i – го вещества. Средняя скорость
Кинетические кривые – кривые, отражающая изменение концентрации какого-либо вещества от времени в ходе реакции А → В С = f (τ)
Задача 1. За 1 с в единице реакционного пространства образуется по трем реакциям 66 г СО2, 68 г Н2S и 51 г NН3. Скорость образования какого из веществ больше? Решение. Количество вещества (ν) в молях каждого из продуктов реакции
Скорость образования NН3 больше, чем скорости образования Н2S и СО2.
Простые (элементарные) реакции протекают в одну стадию. Сложные – суммарный результат протекания нескольких простых реакций. Простые классифицируют по молекулярности. Молекулярность - число молекул, участвующих в элементарном химическом акте: целое (+) число: 1,2, реже 3 1 – мономолекулярные:I2 ® 2I 2 – бимолекулярные: H2 + I2 ® 2HI 3 – тримолекулярные: 2NO + Cl2 ® 2NOCl Запись простой реакции отражает механизм ее протекания, сложной– не отражает механизма протекания процесса: 2N2O5 ® O2 + 2N2 O4 Стадияи: 1 N2O5 ® O2 + N2O3 быстро 2 N2O3 ® NO + NO2 медленно 3 2NO2 ® 2N2O4 быстро медленная стадия (2) – лимитирующая стадия, определяет скорость
Cкорость реакции зависит от: 1) природы реагирующих веществ, 2) концентрации или давления реагирующих веществ, 3) температуры 4) катализатора Влияние концентрации на скорость реакции Условия протекания реакции A+B→ K +L: 1 - одновременное нахождение А и В в определённой точке реакционного пространства; 2 - удачное их столкновение. Вероятность (ω) нахождения молекулы для каждого из веществ прямо пропорциональна его концентрации: ωA = α×CаA, ωB = β×C вB. Вероятность одновременного нахождения обеих молекул в одной точке пространства, т.е. их столкновения: ω = ωA × ωB = α×Cа A × β×Cв B. γ – доля удачных столкновений Уравнение, связывающее скорость реакции с концентрацией исходных веществ - кинетическое. Основное кинетическое уравнение k - константа скорости: а) не зависит от концентрации б) зависит от температуры, природы реагирующих веществ, катализатора, площади поверхности раздела фаз. k – удельная скорость: а, в – частные порядки реакции по веществам А и В (определяются экспериментально) n = (а + в) – общий порядок реакции В простых реакциях: n = 1, 2 редко 3 и общий порядок равен молекулярости. H2 + I2 ® 2HI – простая (элементарная) реакция а(Н2) =1, в(I2) =1 ,т.е. порядки реакции по веществам равны стехиометрическим коэффициентам n = 1+1 =2 Þ
В сложных реакциях: n = 0, целочисленные, дробные, (-),(+) (определяются экспериментально)
Поиск по сайту: |

 моль/(л.с)
моль/(л.с)  моль/ (м2с)
моль/ (м2с)  , моль/л
, моль/л (в определенный промежуток времен ) Мгновенная скорость
(в определенный промежуток времен ) Мгновенная скорость  ( в конкретный момент времени).
( в конкретный момент времени). для исходных веществ - отрицательно, для продуктов – положительно.
для исходных веществ - отрицательно, для продуктов – положительно.



 где R – реакционное пространство, Dν – изменение количества вещества за время Dτ;
где R – реакционное пространство, Dν – изменение количества вещества за время Dτ;


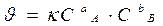
 , если СА = СВ = 1моль/л
, если СА = СВ = 1моль/л закон действующих масс для химической кинетики.
закон действующих масс для химической кинетики.