 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Ферментативный катализ
Этот вид катализа имеет место в биологических системах (биокатализ). Активными, ускоряющими протекание многих биохимических процессов, частицами являются вещества, имеющие органическую, белковую природу – ферменты (энзимы). Некоторые из них состоят из одного компонента (например, пепсин, трипсин и др.); большинство имеет более сложный состав и строение. Можно считать, что фермент представляет собой адсорбционный комплекс, состоящий из ионоорганического соединения, связанного с белковым носителем. В качестве каталитически активных центров обычно служат ионы металлов (обычно d-элементов – Fe2+, Cu2+, Zn2+, V3+ и др.) или полярные группировки (OH–, NH2–, HS– и др.). Основные особенности ферментов: 1) исключительно высокая каталитическая активность. Лучшие неорганические катализаторы по своей активности уступают ферментам в десятки тысяч и более раз. Например, активность ионов железа, входящего в состав ферментов, катализирующих окислительно-восстановительные процессы, протекающие в организмах человека и животных, выше таковой у ионов железа в неорганической форме примерно в триста тысяч раз. В составе ферментов в организме человека содержится 3 - 4 грамма железа, а неорганического железа для выполнения такого же «объёма работы» понадобилось бы около 10 тонн. 2) очень высокая избирательность. Данный фермент, сильно ускоряя протекание одного процесса, оказывается совершенно неактивным для другого. В организме человека одновременно функционируют порядка тысячи ферментов. 3) инактивация. В ходе реакции, активируемой данным ферментом, его каталитическая способность теряется. При этом установлена следующая закономерность: чем активнее фермент как катализатор, тем быстрее он инактивируется в процессе реакции. Этим ферментативный катализ существенно отличается от неорганического, в котором, как уже отмечалось, катализатор к концу реакции остаётся в неизменном виде и теряет активность только в течение более или менее длительного времени.
Цепные реакции
Как уже было отмечено выше, подавляющее большинство химических реакций протекает последовательно, постадийно, и образование макроскопических количеств продукта является результатом ряда элементарных актов реакции, каждый из которых связан с определенным результатом предыдущего акта и, в свою очередь, обусловливает возможность последующего. В зависимости от природы реагирующих веществ и условий их взаимодействия в элементарных актах реакций могут принимать участие атомы, молекулы, ионы или радикалы. Свободными радикалами называют частицы с неспаренными электронами (R·), проявляющие, вследствие этого, очень высокую химическую активность. К свободным радикалам относятся и свободные атомы. При взаимодействии свободных радикалов с молекулами исходных веществ образуются молекулы продукта реакции и новые свободные радикалы, способные к следующему акту взаимодействия, и так далее. Таким образом, свободные радикалы вызывают цепи последовательных превращений веществ. По цепному механизму протекают многие реакции. Их особенность состоит в том, что один первичный акт активации, вызывающий появление в системе первых свободных радикалов, приводит к превращению огромного числа молекул исходных веществ. Различают два типа цепных реакций – с неразветвлёнными и с разветвлёнными цепями. Примером реакции первого типа может служить фотохимический синтез хлористого водорода:
H2+Cl2 = 2HCl
Поглощение кванта лучистой энергии (реакция инициируется действием света) hν приводит к возбуждению молекул, появлению в них энергичных колебаний атомов. Если энергия колебаний превышает энергию связи между атомами, то молекула распадается:
Диссоциации подвергаются именно молекулы хлора, а не водорода, так как энергия связи Cl―Cl равна 243 кДж/моль, а энергия связи Н―Н составляет 436 кДж/моль. Данная стадия цепной реакции, в которой впервые образуются свободные радикалы, называется зарождением цепи. Следующая стадия – развитие или продолжение цепи. Она представляет собой чередующиеся процессы:
Каждый отдельный акт взаимодействия в этой последовательности называется звеном цепи. В рассматриваемом примере число звеньев может достигать 100000. Иначе говоря, один поглощённый квант света приводит к образованию до ста тысяч молекул HCl. Число звеньев цепи, приходящихся в среднем на каждый свободный радикал, получившийся при зарождении цепей, называется длиной цепи. Появление в системе свободных радикалов может быть вызвано также электронным ударом, электрическим разрядом, нагреванием, α, β и γ – излучением.
Стадии цепного процесса, приводящие к исчезновению радикалов, называются обрывом цепи. Обрыв цепи может произойти при столкновении двух свободных радикалов – рекомбинация радикалов при участии одной неактивной частицы (М), которая поглотит выделяющуюся при этом энергию и перейдет в возбужденное состояние:
Если сталкиваются одинаковые радикалы, то обрыв цепи называют квадратичным, если разные - перекрестным:
В обоих случаях скорость обрыва цепей пропорциональна произведению концентраций радикалов. Цепь может оборваться также в результате столкновения свободного радикала со стенкой сосуда; в результате радикалы адсорбируются поверхностью:
Скорость обрыва цепей в этом случае прямо пропорциональна концентрации радикалов, а также сильно зависит от формы, материала и состояния поверхности сосуда. Причиной обрыва цепи может быть и взаимодействие радикала с примесями (если они не служат источником свободных радикалов), а также образование малоактивного радикала (обрыв в объёме). Скорость цепной реакции очень чувствительна к наличию посторонних частиц. Так, содержание в смеси хлора с водородом долей процента кислорода в сотни раз уменьшает длину цепей, а поэтому и скорость реакции. Атом водорода, легко реагируя с молекулой кислорода, образует малоактивный радикал В любом случае, чем выше скорость обрыва цепей, тем меньше их длина и тем ниже скорость реакции, которая в случае неразветвлённого процесса равна произведению скорости зарождения цепей на длину цепи. Энергии активации отдельных стадий цепных реакций обычно в десятки раз меньше, чем энергии активации межмолекулярных реакций, что обусловливает протекание цепных реакций с большой скоростью. Примерами процессов с неразветвлёнными цепями служат также реакции галогенирования углеводородов, полимеризации, многие реакции органических соединений, например, уксусного альдегида. Реакции с разветвлёнными цепями отличаются тем, что в них единичная реакция одного свободного радикала приводит к образованию более чем одного нового свободного радикала. Один из них продолжает цепь, а другой (другие) – начинает (начинают) новую (новые). Примером реакций этого типа служит окисление водорода, которое при определенных условиях протекает следующим образом:
Образующиеся в двух первых реакциях радикалы обеспечивают развитие неразветвлённой цепи, а атом кислорода, обладающий двумя неспаренными электронами, вступая в третью реакцию, даёт два дополнительных радикала, формирующих свои цепи. Так начинается разветвление и получается огромное число свободных радикалов, значительно превышающее концентрации радикалов в неразветвлённых реакциях. «Размножение» радикалов приводит к лавинообразному течению процесса, которое может вызвать взрыв.
Рис.15. Схема нарастания количества свободных радикалов и скорости цепной радикальной реакции
Однако и в этих процессах происходит обрыв цепей. Ясно, что лишь в том случае, когда разветвление цепи идет с большей скоростью, чем ее обрыв, скорость реакции в целом увеличивается. Некоторые вещества, например, тетраэтилсвинец, йод и другие, взаимодействуя с активными частицами (атомами и радикалами), образуют устойчивые соединения, тем самым снижая или полностью устраняя возможность взрыва. Такие вещества называют антидетонаторами. Инициаторы и ингибиторы. Наиболее энергоемкой стадией цепного процесса является реакция инициирования - первичного образования активных частиц. При фото - и радиационно-химическом инициировании цепная реакция может проходить при относительно низких температурах, так как энергии активации реакций продолжения цепи обычно невелики. В случае термического инициирования, то есть реакции гомолитического разрыва связи, для наблюдения цепной реакции необходимо повышение температуры на многие десятки - сотни градусов. Инициирование цепи способно происходить и при введении в смесь реагентов веществ, для которых гомолитический разрыв связи требует незначительной энергии, а образующиеся радикалы достаточно активны для того, чтобы при реакции образовывались переносчики цепи. Характерными веществами – инициаторами являются органические пероксиды и диазосоединения:
В растворах к инициированию цепи приводит добавка веществ, легко отдающих электрон. Например, при добавлении соли Fe(ІІ) в раствор H2O2 (реактив Фентона) происходит реакция
и последующий процесс разложения H2O2 с участием OH как переносчика цепи
Вещества-инициаторы ускоряют цепной процесс, расходуясь по мере его протекания. Превышение скорости реакции над скоростью инициирования - основной признак цепных реакций. Отношение этих скоростей характеризует длину цепи. Добавка ингибитора (In) уменьшает концентрацию переносчиков цепи R· за счет создания дополнительных каналов их гибели. Простейшим по механизму действия является ингибитор - стабильный радикал, При молекулярной природе ингибитора продукт его взаимодействия с Применение ингибиторов для практических целей позволяет увеличить сроки хранения технических и пищевых жиров и масел, сроки годности лекарственных препаратов, уменьшить процент разложения компонентов ракетных топлив при длительном хранении, увеличить сроки сохранения технических свойств полимерных веществ и т.п. Накоплен опыт использования ингибиторов в качестве лекарственных препаратов, тормозящих развитие опухолей и старения. (Большой вклад в изучение механизмов действия ингибиторов и развитие методов их применения в химической практике и медицине сделан Н.М.Эмануэлем и учеными его школы.) Наиболее распространены ингибиторы процессов окисления органических веществ. Их называют антиоксидантами. Общей характеристикой антиоксидантов является наличие в молекуле слабосвязанного атома водорода, с которым и взаимодействуют радикалы - переносчики цепи. Большинство антиоксидантов относится к классу ароматических фенолов и аминов. Антиоксидантом природного происхождения является, в частности, аскорбиновая кислота - витамин С. Важнейшими крупномасштабными промышленными нефтехимическими процессами, химическую основу которых составляют цепные реакции, являются полимеризация ненасыщенных соединений, крекинг нефти и окисление органических веществ. К цепным процессам относятся и ядерные цепные реакции. Здесь роль активной частицы играет нейтрон, проникновение которого в ядро атома может и привести к его распаду, сопровождающемуся выделением большой энергии и образованием новых свободных нейтронов, продолжающих цепь ядерных превращений.
Поиск по сайту: |




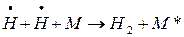
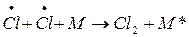

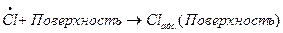
 , не способный вступать в реакцию с молекулой водорода, которая привела бы к регенерации атома
, не способный вступать в реакцию с молекулой водорода, которая привела бы к регенерации атома 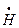 (изменение энергии Гиббса процесса
(изменение энергии Гиббса процесса  – величина положительная,
– величина положительная,  кДж). В то же время радикалы
кДж). В то же время радикалы 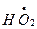 могут взаимодействовать между собой (
могут взаимодействовать между собой ( 
 кДж), и цепь обрывается.
кДж), и цепь обрывается.

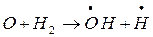






 и другие , не взаимодействующие с молекулами реагентов, но реагирующие хотя бы с одним из радикалов - переносчиков цепи.
и другие , не взаимодействующие с молекулами реагентов, но реагирующие хотя бы с одним из радикалов - переносчиков цепи. не участвует в продолжении цепи, а накапливается или рекомбинирует:
не участвует в продолжении цепи, а накапливается или рекомбинирует:  или взаимодействует с еще одним переносчиком цепи:
или взаимодействует с еще одним переносчиком цепи: 