 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ВЛИЯНИЕ ИЗМЕНЕНИЯ ВНЕШНИХ УСЛОВИЙ НА СОСТОЯНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
После изменения внешних условий состояние химического равновесия нарушается, т.к. скорости прямой и обратной реакций в разной степени зависят от этих изменений. Происходит сдвиг равновесия в сторону прямой (вправо) или обратной (влево) реакции, после чего в системе установится новое состояние равновесия, при котором равновесные концентрации реагентов будут отличны от предыдущих. В качественной форме, направление смещения равновесия можно определить, пользуясь принципом Ле Шателье: «Если на систему (реакцию), находящуюся в состоянии равновесия оказать какое-либо внешнее воздействие, то равновесие сместится в том направлении, при котором это воздействие уменьшается». Иными словами равновесная система стремится сохранить старое состояние равновесия и противодействует внешнему воздействию. К наиболее очевидным факторам, способным повлиять на состояние химического равновесия, относятся температура и концентрация реагентов. Для реакций, протекающих с участием газов при постоянной температуре, дополнительным фактором является давление, т.к. его изменение приводит к изменению объема и, следовательно, к изменению концентрации газовых реагентов, причем в разной степени для исходных веществ и продуктов реакции. Рассмотрим влияние этих факторов на смещение равновесия в системе: N2(г) + 3H2(г) ⇄ 2NH3(г) , DНхр< 0 (I)
1. Влияние давления. При повышении давления равновесие в системе смещается в сторону меньшего количества молей газообразных веществ. В данной системе произойдет смещение равновесия вправо, т.е. в сторону прямой реакции. И наоборот, при уменьшении давления равновесие в системе смещается в сторону большего количества молей газообразных веществ. В данной системе произойдет смещение равновесия влево, т.е. в сторону обратной реакции. При изменении давления в системе не произойдет смещения равновесия, если количество моль газообразных веществ в ходе реакции не изменяется. 2. Влияние концентрации реагентов. Изменение концентрации одного или нескольких реагентов в равновесной смеси приведет к смещению равновесия, причем увеличение концентрации исходных веществ сдвигает равновесие вправо, что увеличивает выход продуктов. К такому же эффекту приводит отвод продуктов из равновесной смеси (например, сжижение аммиака и откачка его из реактора). Увеличение концентрации продуктов реакции или уменьшение концентрации исходных веществ вызывает смещение равновесия влево, т.е. в сторону исходных веществ. 3. Влияние температуры. По отношению к обратимым химическим процессам повышение температуры вызывает сдвиг равновесия в сторону реакции, протекающей с поглощением тепла (эндотермической реакции), понижение температуры – в сторону реакции, протекающей с выделением тепла (экзотермической реакции). Константа равновесия реакции связана со стандартным изменением свободной энергии Гиббса соотношением DG0х.р. = - RT lnKp, а DG0х.р. = DН0х.р. - Т∙DS0х.р. Тогда lnKp =
Для реакции (I), протекающей с выделением тепла (DНхр<0), увеличение температуры приведет к уменьшению Кр. Это значит, что количество продуктов реакции уменьшится, а количество исходных веществ увеличится, т.е. равновесие сместится влево, т.к. обратная реакция протекает с поглощением тепла. И наоборот, для реакции, протекающей с поглощением тепла (DНхр>0), при увеличении температуры Кр увеличится, т.е. равновесие сместится вправо (в сторону эндотермической реакции). Таким образом, при увеличении температуры константа равновесия эндотермической реакции (DНхр>0) увеличивается, а зкзотермической реакции (DНхр<0) – уменьшается.
Поиск по сайту: |
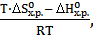 lnKp =
lnKp = 