 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Сходство со щелочными металлами
(1) Водород и щелочные металлы имеют одинаковые конфигурации внешнего электронного уровня (s1) и, как следствие, похожие оптические спектры. (2) Со ЩМ водород объединяет способность отдавать электроны и, значит, восстанавливать другие элементы. Однако, из-за малого радиуса атома Н (и, как следствие, высокой энергии его ионизации) Поэтому реагируют с Имея дело с водородом на практике, следует помнить, что смесь его с О2, содержащая от 7 до 67% (об.) При горении скорость реакции сравнительно небольшая и определяется быстротой смешивания Отметим, что реакции синтеза хлороводорода и аммиака:
имеют промышленное значение. Благодаря восстановительным свойствам, водород (как и ЩМ) вытесняет металлы из их оксидов. Это используется в металлургии, например, при получении железа (из руды):
(3) Сходство водорода и ЩМ проявляется также в том, что в водном растворе продукты их окисления присутствуют в виде однозарядных гидратированных катионов (в отличие от галогенов). 39. Энтропи́я (от греч. ἐντροπία — поворот, превращение) в естественных науках — мера беспорядка системы, состоящей из многих элементов. Особенности водорода Одна из особенностей водорода состоит в том, что его простое вещество Н2 имеет минимальную молекулярную массу (Мr) и, значит, является самым легким газом (в 14,5 раз легче воздуха, поэтому им наполняют стратостаты, дирижабли и т.п.). Легкостью водорода объясняется низкое его содержание в атмосфере (всего 10‑4%), хотя на Земле постоянно идут процессы образования Н2. Например, при разложении органических веществ без доступа воздуха. Выделяется он и во время извержения вулканов, при бурении нефтяных скважин (в составе природного газа), а также зелеными листьями растений (при их дыхании). Однако, почти весь водород улетучивается на высоту примерно 100 км, где атомизируется и ионизируется до Другой особенностью водорода является то, что энергия связи Н–Н очень велика – составляет 435 кДж/моль. (Самая прочная из всех ординарных ХС.) Это объясняется тем, что в Как следствие: а) для реакций с участием Н2 высока энергия активного состояния Еа.с., т.е. процессы идут в достаточно жестких условиях. Например, сероводород (H2S) образуется при пропускании струи водорода над кипящей серой. Таким образом, Н2 не только термодинамически, но и кинетически пассивнее, чем Г2 или ЩМ. б) из-за большой прочности и, как следствие, жесткости связи Н–Н молекулы водорода (неполярные) обладают незначительной поляризуемостью. А значит, способны лишь к очень слабым дисперсионным взаимодействиям с другими частицами, в том числе, с молекулами растворителей. Поэтому ничтожна растворимость в) особенно слабы дисперсионные взаимодействия молекул водорода между собой. К тому же, частицы Третья особенность водорода состоит в том, что, в отличие от иных катионов, а) ион Н+, приближаясь к другим атомам, не испытывает межэлектронного отталкивания (ибо нечем отталкиваться от е другого элемента). Поэтому положительно заряженный водород одной молекулы может образовать дополнительную прочную связь с атомом элемента соседней молекулы, если этот атом достаточно отрицательно заряжен. Как, например, F, O или N в соединениях HF,
б) являясь «голым» протоном, катион водорода имеет повышенную электрофильность (т.е. любовь к е). Поэтому в соединениях, в частности, в кислородосодержащих кислотах, 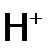 в значительной степени перетягивает электроны на себя (что на рисунке 1 отражено стрелками). Это, во-первых, ослабляет связи в анионе, а во-вторых, делает его несимметричным, а потому менее устойчивым. Такое явление называют поляризующим действием катиона на анион или поляризацией. в значительной степени перетягивает электроны на себя (что на рисунке 1 отражено стрелками). Это, во-первых, ослабляет связи в анионе, а во-вторых, делает его несимметричным, а потому менее устойчивым. Такое явление называют поляризующим действием катиона на анион или поляризацией.
В частности, из-за сильного поляризующего действия Н+ на карбонат-анион угольная кислота настолько нестабильна, что существует только в разбавленных растворах, а при попытке выделить ее в свободном состоянии полностью распадается на оксиды. Механизм распада показан на рис. 1, а в краткой форме этот распад отражается уравнением:
В то же время карбонат натрия ( 41Электролитическая диссоциация – это распад молекул растворенного вещества на ионы под действием растворителя. Количественно способность распадаться на ионы характеризуется степенью диссоциации ( В зависимости от значения Слабыми электролитами называют вещества, в 0,1М растворах которых наряду с ионами существуют и неионизированные молекулы ( Если 0,1М раствор не содержит молекул исходного вещества в недиссоциированном виде, т.е. Отметим, что кажущаясястепень диссоциации сильных электролитов меньше единицы, хотя отсутствие молекул в таких растворах доказано спектральным методом. Указанное противоречие объясняется наличием в этих растворах ассоциатов (в частности, ионных пар), в которых связь между ионами осуществляется хотя бы через одну молекулу воды: Более строгой величиной (чем
В случае многоосновных слабых кислот (и аналогичных оснований) диссоциация идет по ступеням. Причем 1-ая ступень протекает в большей степени, чем 2-ая (а 2-ая, чем 3-я), т.к. незаряженная частица, например, молекула сернистой кислоты, легче диссоциирует с отщеплением протона:
чем отрицательно заряженный анион (в соответствии с законом Кулона):
Многостадийные процессы характеризуют с помощью т.н. ступенчатых
Подчеркнем, что
43.1 закон. В любой изолированной системе запас энергии остаётся постоянным. Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц. 44. Все основные свойства металлов (М): блеск, пластичность, электропроводность и непрозрачность, – обеспечиваются присутствием в их решетке относительно свободных электронов. Наиболее заметное свойство М – это характерный т.н. металлический блеск; он обусловлен способностью М отражать свет, не рассеивая его[39]. Другим свойством М является пластичность, т.е. под ударом молота они не дробятся на куски, как, например, алмаз, а лишь расплющиваются. Хотя все металлы проводят ток, но в разной степени. Наименьшую электропроводность (l) среди М имеет ртуть (ее l принята за единицу), а наибольшую – серебро (l=59). Это значит, что проводимость Ag в 59 раз выше, чем у Hg. Золото же, хотя и является самым пластичным металлом, но по электропроводности (l=40) уступает даже меди (l=57). Если же сравнивать М по восстановительным свойствам в водной среде, т.е. по значению Е0, то наиболее металлическим окажется литий – именно он возглавляет ряд напряжений М. Таким образом, абсолютного чемпиона по металличности нет. Кроме того, следует различать понятия «металл» как элемент и «металл» как вещество. Первое зависит от положения Э в таблице Д.И. Менделеева. И чем левее и ниже он расположен (т.е. чем больше его атомный радиус), тем, как правило, более металлическими свойствами обладает элемент. В частности, тем легче отнять электрон у атома Э и тем с меньшим «желанием» его атом присоединяет е, а значит, тем ниже электроотрицательность элемента. И поскольку цезий обладает наименьшим значением ЭО (0, 70), то он и является самым металлическим Э. Напоминаем, что к металлам относят элементы, имеющие ЭО менее 1.8. Это все s-, d- и f-Э, а также p-элементы, лежащие ниже диагонали, проходящей в периодической таблице через водород, бериллий, алюминий, германий, сурьму и полоний[40]. Причем Be, Al и Po тоже относят к М, которых таким образом насчитывается 92 из 116 элементов, открытых на сегодняшний день. Еще больше металлов-веществ. Ибо к ним относят не только простые соединения, которые обычно образованы металлами-элементами (Fe, Al, Na и т.п.), но и многие сложные вещества. Например, один из образцов алхимического «золота» состава Hg2,86AsF6 (действительно имеющего золотистый цвет) проводит ток, как и М. Кроме того, даже типичные неметаллы: фосфор, сера и др. при сверхвысоком давлении становятся М. В частности, под давлением 3 млн. атм. металлизируется даже Н2. Это происходит потому, что под таким давлением увеличивается плотность упаковки атомов в решетке вещества, т.е. растет к.ч. элемента, а следовательно, число химических связей каждого атома с другими. Как результат, сами связи ослабевают. А это значит, что электроны менее прочно удерживаются на осях ХС, т.о. становясь свободнее. Вследствие чего и возникает металличность. И наоборот: разрыхление структуры (из-за снижения к.ч. элемента) приводит к потере имевшихся металлических свойств. Итак, металличность элемента – это свойство (раз и навсегда данное), а металличность вещества – это его состояние, которое зависит от условий. Типичные М разделяют на легкие, если их удельная плотность ниже 5 г/см3 (самый легкий – литий (0,53 г/см3)), и тяжелые (например, осмий (22,5 г/см3)); а также на легкоплавкие, если т.пл. ниже 10000С (минимальная – у ртути (-340С)) и тугоплавкие (максимальную т.пл. имеет вольфрам (34200С)). 45. Химическая кинетика – раздел химии, рассматривающий скорость химических процессов и их механизм. Скорость теоретически определяется числом элементарных актов взаимодействия[41] в единицу времени в единице объема (в гомогенных системах) или на единице поверхности (для гетерогенных реакций). На практике независимо от того гомогенной или гетерогенной является система, скоростью процесса считают изменение концентрации какого-либо вещества в единицу времени в жидкой или газовой фазе.
Поиск по сайту: |
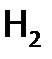 как восстановитель гораздо слабее, чем ЩМ (сравним:
как восстановитель гораздо слабее, чем ЩМ (сравним: 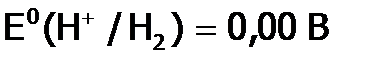 , a, например, Е0 (Na+/ Na)= –2,71 В).
, a, например, Е0 (Na+/ Na)= –2,71 В).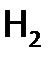 , взрывоопасна (причем взрыв может произойти от искры или при контакте с нагретым предметом). В то же время струя чистого водорода спокойно горит в кислороде. (Продукт и взрыва, и горения одинаков – вода.)
, взрывоопасна (причем взрыв может произойти от искры или при контакте с нагретым предметом). В то же время струя чистого водорода спокойно горит в кислороде. (Продукт и взрыва, и горения одинаков – вода.)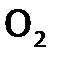 на поверхности водородной струи. А в смеси
на поверхности водородной струи. А в смеси 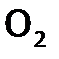 молекулы уже максимально перемешаны, поэтому скорость процесса многократно выше.
молекулы уже максимально перемешаны, поэтому скорость процесса многократно выше. ,
,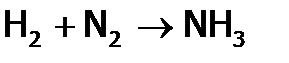
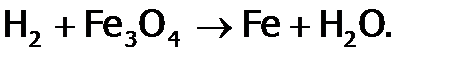
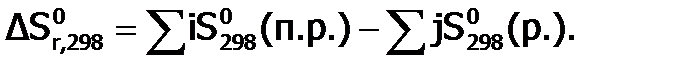 2 закон реакции могут самопроизвольно идти только с потерей энергии.
2 закон реакции могут самопроизвольно идти только с потерей энергии. крайне подвижны (наиболее подвижные среди всех молекул). И потому требуется особенно глубокое охлаждение для сжижения[37] водорода. Как следствие (и ничтожной величины дисперсионных взаимодействий, и минимального значения Мr),
крайне подвижны (наиболее подвижные среди всех молекул). И потому требуется особенно глубокое охлаждение для сжижения[37] водорода. Как следствие (и ничтожной величины дисперсионных взаимодействий, и минимального значения Мr),  не имеет электронов. Следствием этого является следующее:
не имеет электронов. Следствием этого является следующее: и
и  соответственно (а также в органических веществах, содержащих эти элементы). Такие связи между молекулами называются водородными. Они направлены, насыщаемы и значительно прочнее, чем межмолекулярные связи.
соответственно (а также в органических веществах, содержащих эти элементы). Такие связи между молекулами называются водородными. Они направлены, насыщаемы и значительно прочнее, чем межмолекулярные связи.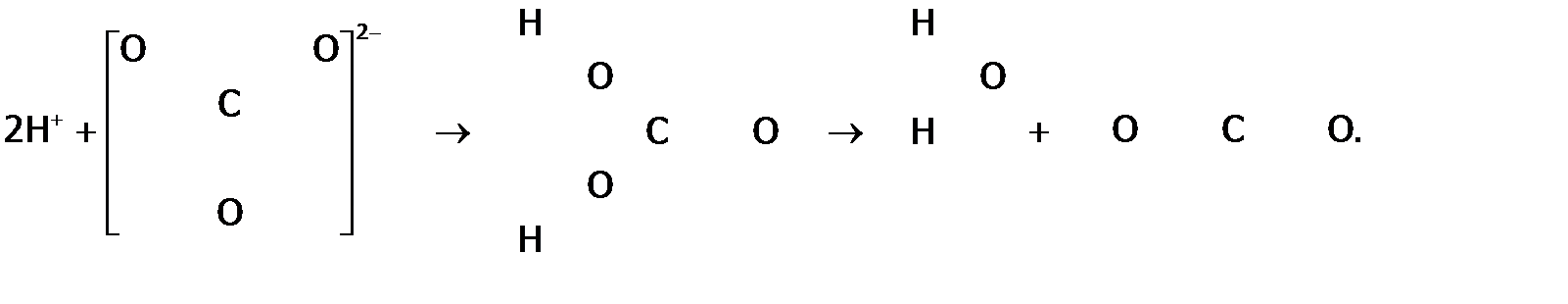
 .
. ) даже плавится (при 8580С) без разложения, ибо
) даже плавится (при 8580С) без разложения, ибо 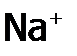 очень слабо поляризует анион из-за низкой ЭО натрия (0,9), гораздо меньшей, чем ЭО водорода (2,1). Другие металлы тоже имеют ЭО ниже, чем Н, и это одна из причин, по которой кислоты менее устойчивы, чем их соли.
очень слабо поляризует анион из-за низкой ЭО натрия (0,9), гораздо меньшей, чем ЭО водорода (2,1). Другие металлы тоже имеют ЭО ниже, чем Н, и это одна из причин, по которой кислоты менее устойчивы, чем их соли. ). Она показывает, какая доля от общего количества данного соединения присутствует в растворе в виде ионов.
). Она показывает, какая доля от общего количества данного соединения присутствует в растворе в виде ионов. различают сильные и слабые электролиты.
различают сильные и слабые электролиты. ). К ним относятся гидрат аммиака, все органические основания и кислоты; из неорганических кислот:
). К ним относятся гидрат аммиака, все органические основания и кислоты; из неорганических кислот:  ,
, 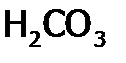 ,
,  ,
, 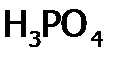 ,
, 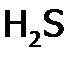 ,
, 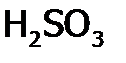 и т.п.
и т.п. , то электролит называют сильным. Это почти все растворимые основания (т.е. щелочи) и соли, а также неорганические кислоты (в которых, как правило, анионообразующий элемент, находясь в высшей ст.ок., имеет достаточно высокую электроотрицательность):
, то электролит называют сильным. Это почти все растворимые основания (т.е. щелочи) и соли, а также неорганические кислоты (в которых, как правило, анионообразующий элемент, находясь в высшей ст.ок., имеет достаточно высокую электроотрицательность):  ,
,  ,
,  и т.п.
и т.п.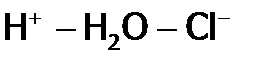 . Коротко их записывают
. Коротко их записывают  , в отличие от недиссоциированных молекул
, в отличие от недиссоциированных молекул  .
. ), не зависящей от состава раствора, является термодинамическая константа равновесия, которая называется константой диссоциации (
), не зависящей от состава раствора, является термодинамическая константа равновесия, которая называется константой диссоциации (  ). Например, для уксусной кислоты, имеем:
). Например, для уксусной кислоты, имеем: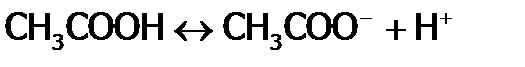 ,
, 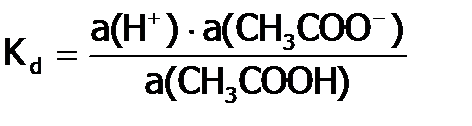 .
.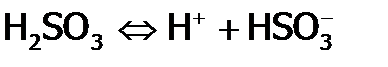 ,
, .
.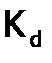 , которые индексируются цифрой, соответствующей номеру ступени, в частности, для диссоциации ортофосфорной кислоты с отщеплением второго протона имеем:
, которые индексируются цифрой, соответствующей номеру ступени, в частности, для диссоциации ортофосфорной кислоты с отщеплением второго протона имеем: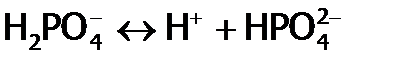 ,
, 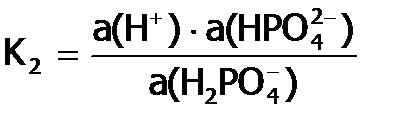 .
. , получим:
, получим: 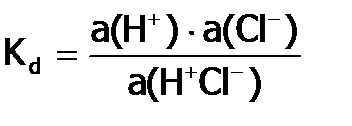 , где
, где 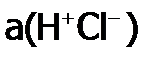 – активность ионных ассоциатов в растворе
– активность ионных ассоциатов в растворе  . В этом случае она называется кажущейся константой диссоциации.
. В этом случае она называется кажущейся константой диссоциации. (п.р.)
(п.р.)  (р.).
(р.).