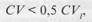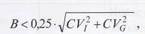|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Внутрилабораторный контроль качества
К тестам на исследование гемостаза предъявляются такие же требования по контролю качества, как и к другим лабораторным исследованиям. Все тесты в лаборатории должны быть обеспечены внутрилабораторным контролем качества, лаборатории должны участвовать в программах межлабораторного контроля качества. При проведении внутрилабораторного контроля контрольные пробы необходимо включать в каждую серию измерений. По крайней мере, исследования на контрольной плазме необходимо проводить ежедневно, обязательно при постановке новой серии с новым реактивом, после профилактики прибора, при введении нового метода или его модификации. Для каждого контролируемого показателя строятся контрольные карты с использованием, по крайней мере, 2 контрольных проб - с показателями в нормальном и патологическом диапазоне. Фирма «Bio-Rad» (наиболее известный производитель контрольных материалов в мире) для проведения контроля качества выпускает контрольные материалы для исследования коагуляции 3 уровней под общим наименованием «Lyphochek Coagulation». Если проводится лекарственный мониторинг, то желательно использовать контрольные материалы с показателями в терапевтическом диапазоне. При использовании автоматических коагулометров часто реактивная база закрыта, в этом случае необходимо использовать контрольные материалы для данной технологии, предоставляемые поставщиками такой продукции. В случае отсутствия контрольных материалов с установленными показателями для коагулологи-ческих тестов следует применять аликвотированные сливные плазмы для контроля воспроизводимости. Требования к аналитическому качеству, принятые в настоящее время в России, изложены в Обеспечение диагностики нарушений гемостаза в КДЛ
двух документах: приказе МЗ РФ № 45 и отраслевом стандарте ОС 91500.13.0001-2003. Согласно этим документам требуемое аналитическое качество аналитов определяется следующими характеристиками: 1. «Предельно допустимые значения смещения (В) 2. «Биологически обоснованные нормы анали
Целевое значение коэффициента общей аналитической вариации не должно превышать половины коэффициента внутрииндивиду-альной вариации, или: фициент внутрииндивидуальной биологической вариации, %. Требования к целевому значению смещения формулируются в виде неравенства:
где В - целевое значение смещения средней арифметической от установленного значения, %; CVl - коэффициент внутрииндивиду-альной биологической вариации, %; CVG -коэффициент межиндивидуальной биологической вариации, %. Таблица 36 Биологически обоснованные нормы аналитической точности клинических лабораторных исследований Внелабораторный контроль качества Межлабораторный контроль качества показателей гемостаза организован в рамках Федеральной системы внешней оценки качества лабораторных исследований (ФСВОК). Ниже приведены соответствующие программы, в которых должна участвовать каждая КДЛ, занимающаяся исследованием гемостаза. Раздел ФСВОК «Коагулология»: оценка качества исследований показателей плазмы крови в нормальном и патологическом диапазонах - протромбиновое время (индекс и международное нормализованное отношение); АЧТВ (индекс); фибриноген и тромбиновое время (индекс). Контрольные образцы: лиофилизированная плазма человека. Число циклов за год: 3 или 6 по выбору лаборатории. «Коагулология-1,5»: для лабораторий, которым для двукратного измерения всех исследуемых из числа вышеперечисленных показателей достаточно 1,5 мл плазмы. «Коагулология-3»: для лабораторий, которым для двукратного измерения всех исследуемых из числа вышеперечисленных показателей достаточно 3,0 мл плазмы. «Коагулология-4,5»: для лабораторий, которым для двукратного измерения всех исследуемых из числа вышеперечисленных показателей достаточно 4,5 мл плазмы.
Патология гемостаза ПАТОЛОГИЯ ГЕМОСТАЗА
В норме в организме гемостатический баланс сохраняется при широком диапазоне активности различных компонентов. Однако в случае возникновения значительного дисбаланса компонентов системы гемостаза развиваются нарушения, характеризующиеся повышенной кровоточивостью, либо повышенной склонностью к тромбообразо-ванию, либо одновременно обоими этими явлениями. К сожалению, в рамках настоящего издания нет возможности представить все аспекты нарушений гемостаза; здесь будут охарактеризованы только наиболее распространенные клинически значимые формы патологии свертывания крови. Теоретически геморрагические проявления могут возникать при дефиците прокоагулянтов или избытке антикоагулянтов, а тромботические -наоборот. Однако в действительности, как правило, возникают более сложные ситуации. Например, патологическое снижение активности фиб-ринолиза или значительное повышение активности факторов свертывания крови на практике нечасто приводят к развитию тромбозов, а снижение активности фактора XII или высокая актив- ность антитромбина III могут не иметь клинических проявлений в виде кровоточивости. В общем виде петехии, пурпура, кровотечения из слизистых и носовые кровотечения характерны для нарушений сосудистой стенки и тромбоцитов (патология сосудисто-тромбоцитарного гемостаза). Обширные кровотечения в мышцы, полости, суставы характерны для нарушений плазменного гемостаза, включая патологию фиб-ринолиза и антикоагулянтов. Помимо изменения активности различных компонентов гемостаза, у пациентов с тромботи-ческими проявлениями возможны так называемые «протективные» нарушения, т. е. нарушения субстрата, защищающие его от воздействия ингибитора или системы элиминации. При этом активность этого фактора (субстрата) может оставаться в пределах нормы, но неконтролируемое его участие в свертывании приводит к неограниченному тромбообразованию. В табл. 37 описаны генетически детерминированные изменения активности некоторых факторов свертывания крови. Таблица 37 Генетически детерминированные изменения некоторых факторов свертывания
Патология гемостаза Окончание табл. 37
Патология гемостаза Задачи лабораторной службы при ведении пациентов с подозрением на нарушения системы гемостаза При ведении пациентов с подозрением на нарушения системы гемостаза, как ни в каком другом разделе медицины, важны результаты лабораторных исследований. Многие геморрагические заболевания имеют сходную клиническую картину, однако требуют разных терапевтических подходов. Только лабораторная диагностика позволяет установить точный диагноз и назначить современную адекватную терапию. Тромбо-тические проявления, как правило, возникают при сочетании разных протромботических факторов, как врожденных, так и приобретенных. Лабораторная диагностика позволяет выявить эти факторы и провести не только лечение развившегося тромбоза, но и фоновых изменений и предупредить рецидивы тромбозов, контролируя терапию. Без правильных современных лабораторных исследований невозможно лечение и профилактика нарушений гемостаза. Основными задачами лаборатории при ведении пациентов с нарушениями гемостаза являются: 1. Диагностика нарушений системы гемостаза: • выявление нарушенного звена или зве • уточнение характера нарушения (дефи 2. Контроль проводимой терапии. Врожденные геморрагические заболевания Наследственные геморрагические коагулопатии
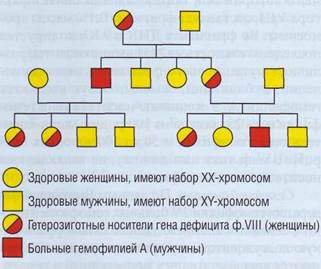
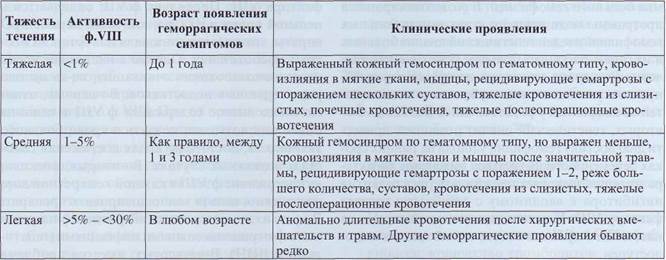
Наследственные геморрагические коагулопатии, как правило, связаны с генетически детерминированным дефицитом активности факторов свертывания крови. В подавляющем большинстве случаев имеется изолированный дефект одного из факторов, однако возможны комбинированные дефекты. В редчайших случаях геморрагические проявления могут быть связаны со значительным усилением активности антикоагулянтов, например плазминогена, что, как правило, является следствием генетически детерминированного дефицита ингибиторов. Наследственная недостаточность факторов свертывания встречается в популяции относительно редко. Болезнь чаще всего имеет семейный характер, проявляется в детстве, а больные концентрируются в гематологических центрах. Среди наследственных геморрагических заболеваний наиболее частой является болезнь Виллебранда, которая в некоторых популяциях встречается с частотой до 1%. Однако классически болезнь Виллебранда не относят к коагулопатиям. Среди наследственных геморрагических коагулопатии наиболее распространены гемофилия А и В, гораздо реже встречается дефицит ф.VII (гипопро-конвертинемия). Дефицит других факторов свертывания встречается еще реже, а его распространенность сильно зависит от особенностей популяции. Например, дефицит ф.ХI широко распространен в популяции евреев-ашкенази, а в других популяциях встречается лишь спорадически. Гомозиготный дефицит ф.Х, приводящий к тяжелым геморрагическим проявлениям, встречается чаще в популяциях, где распространены родственные браки. Лечение заболеваний, связанных с наследственным дефицитом факторов свертывания, в основном заключается в коррекции дефицита препаратами, содержащими отсутствующий фактор. Такие препараты производят из донорской плазмы или получают генноинженерным путем (рекомбинантные препараты). Также для лечения может применяться свежезамороженная или лиофилизированная плазма или ее первичные производные - криопреципитат или супер-натант. Патология гемостаза Гемофилия А Гемофилия А - геморрагическая коагулопа-тия, связанная со снижением активности фактора VIII в крови. Выделяют наследственную форму гемофилии, связанную с мутациями гена фактора VIII и приобретенную гемофилию. Наследственная гемофилия А Ген фактора VIII расположен в Х-хромо-соме, наследственная гемофилия А - заболевание, сцепленное с полом. Тяжелый врожденный дефицит ф.VIII встречается у лиц мужского пола. Женщины являются носителями гена, но у них очень редко возникают геморрагические проявления, связанные с дефицитом ф.VIII (рис. 130). Девочки могут иметь клинические проявления врожденной гемофилии в нескольких случаях: если обе Х-хромосомы с дефектным геном ф.VIII (отец болен гемофилией, а мать является носителем гена гемофилии и передала ей дефектную хромосому); если активна только одна Х-хромосома с дефектным геном ф.VIII (например, при синдроме Шере-шевского-Тернера) и др. Гемофилия А - наиболее распространенная геморрагическая коагулопатия. Встречается, по разным данным, с частотой от 3 до 20 случаев на 100 000 мужского населения. Примерно в половине случаев диагностируется тяжелая форма за- болевания. В настоящее время существует несколько классификаций гемофилии по тяжести. Все они основаны на определении активности ф.VIII в крови. В табл. 38 приведена классификация гемофилии А, рекомендованная Всемирной федерацией гемофилии. Помимо приведенной, предложены другие классификации, в которых тяжелая форма диагностируется при уровне фактора до 2 или 3%.
Рис. 130. Генетическое древо наследственной гемофилии.Поскольку ген ф.VIII и ф.IХ находится в Х-хромосоме и отсутствует в Y-хромосоме, риск передачи его от матери составляет 50%, а риск рождения мальчика - 25%
Клиническая классификация гемофилии А Таблица 38
Патология гемостаза
При тяжелой форме гемофилии А активность ф.VIII в крови практически не меняется в течение жизни. При среднетяжелой - возможны колебания в незначительных пределах, а при легкой форме активность фактора может изменяться, в том числе повышаться, особенно при применении синтетических аналогов ва-зопрессина. Генетика гемофилии А. Врожденная гемофилия А обусловлена дефектами в Х-хромосо-ме, в которой ген, определяющий синтез фактора VIII, составляет фрагмент 0,1% массы хромосомы. Во фрагменте ДНК в 9 Kb кодируется последовательность из 2351 аминокислоты, различные мутации этого фрагмента, включая де-леции, дубликации, замены, могут вызывать гемофилию А. У женщины-носителя гена гемофилии есть 25 шансов из 100 родить дочь-носителя гена гемофилии и 50 из 100 - родить здорового мальчика или девочку, не являющуюся носителем гена гемофилии. Семейный анамнез. По данным Всемирной федерации гемофилии 2/3 больных гемофилией имеют в семейном анамнезе данные за геморрагическую коагулопатию, а у трети - нарушения выявляются впервые. Анализ, проведенный в гематологическом центре Измайловской ДГКБ г. Москвы, показал другие результаты: среди семей, в которых есть дети, больные гемофилией, лишь около 1/3 до момента рождения больного ребенка знали о наличии геморрагических проявлений у членов семьи. Анализ ДНК гена фактора VIII в настоящее время является важной частью обследования семьи больного гемофилией. В развитых странах в программы медицинского страхования больных гемофилией введен генетический анализ больных и их семей, что имеет большое практическое значение. Во-первых, это позволяет проводить семейную консультацию с оценкой риска рождения детей с гемофилией у родственников больного. Во-вторых, генетический анализ позволяет провести диагностику гемофилии у плода на ранних сроках беременности. В-третьих, выяснение характера мутации позволяет предсказать риск развития ингибитора к вводимому с лечебными целями фактору VIII. К сожалению, в нашей стране до настоящего времени генетический анализ малодоступен. Клинические проявления гемофилии А Для гемофилии А характерны отсроченные кровотечения и кровоизлияния, возникающие после травмы. Поскольку при гемофилии не страдает первичный тромбоцитарный гемостаз, при травмах сосудов небольшого калибра кровотечения останавливаются. Однако аномально длительный процесс свертывания крови не позволяет создать своевременно плотный тромб, что приводит к рецидиву кровотечения. В зависимости от тяжести гемофилии без адекватного лечения вторичное кровотечение может остановиться через некоторое время, но может длиться очень долго, приводя к тяжелой анемии. Очень характерным для гемофилии является кровоизлияние в элементы опорно-двигательного аппарата. Гематомы мышц и рецидивирующие кровоизлияния в суставы приводят этих больных к нарастающему остеопорозу, мышечной дистрофии, артрозам крупных суставов. Значительное поражение опорно-двигательного аппарата у неправильно леченных пациентов с тяжелой гемофилией А формируется к младшему школьному возрасту. Наиболее значимыми осложнениями гемофилии являются поражение опорно-двигательного аппарата, хроническая постгеморрагическая (железодефицитная) анемия. У пациентов, имевших в анамнезе внутричерепные кровоизлияния, выявляется остаточная неврологическая симптоматика. Лечение гемофилии Основным патогенетическим методом лечения гемофилии А является введение препаратов фактора VIII. Поскольку ф.VII содержится в цельной крови и плазме, это были первые препараты, которые использовали для остановки острых кровотечений. Однако в настоящее время от их использования отказались из-за целого ряда серьезных недостатков. Во-первых, относительно низкое содержание ф.VIII в единице объема не позволяет создать в крови больного активность, достаточную для достижения гемостаза в сложных случаях. Во-вторых, поскольку содержание ф.VIII в каждой конкретной дозе неизвестно, нельзя точно дозировать препарат. В-третьих, имеется высокий риск инфицирования гемотрансмиссивными инфекциями (гепатитами и ВИЧ). В-четвертых, имеется проблема Патология гемостаза хранения. Цельная кровь и плазма могут храниться только при температурах ниже -20 °С ограниченное время, что исключает их применение вне больницы. В-пятых, при частом применении возрастает число аллергических и анафилактических реакций. Препаратом следующего поколения стал кри-опреципитат - осажденная при +4 °С часть плазмы, содержащая большое количество ф.VIII, фибриногена и ф.ХIII. По сравнению с кровью и плазмой криопреципитат содержит большее количество ф.VIII на единицу объема, что позволяет останавливать кровотечения даже при некоторых хирургических вмешательствах. Однако в остальном криопреципитат обладает теми же недостатками. В качестве гемостатического препарата при гемофилии А в развитых странах он практически не применяется. Революционным шагом стала разработка высокоочищенных препаратов ф.VIII. Это позволило создать препараты с высокой активностью ф.VIII в малом объеме, что решило проблему достижения любой необходимой концентрации ф.VIII в крови реципиента. К тому же разработанные методы удаления вирусов позволили свести на нет риск заражения наиболее значимыми инфекциями, передающимися через кровь, - ВИЧ, гепатитами В и С. Современные препараты концентратов ф.VIII представляют собой лиофилизированный порошок с точно определенной активностью ф.VIII. Препарат может храниться при комнатной температуре до 6 месяцев, а при +2... +8 °С - до 2 лет, что позволяет легко использовать его в домашних условиях. Однако такие препараты стоят дорого. Создание концентратов ф.VIII сделало возможным их профилактическое введение для предотвращения кровоизлияний в суставы. В настоящее время разработано четвертое поколение ан-тигемофильных препаратов - концентраты ре-комбинантного ф.VIII. При их производстве вообще не применяются компоненты крови человека, что теоретически полностью исключает риск инфицирования гемотрансмиссивными вирусами. К сожалению, стоимость этих препаратов значительно выше, чем препаратов производных человеческой плазмы. Современные подходы к лечению гемофилии, с учетом стоимости гемостатических препаратов, требуют регулярного контроля состояния гемостаза с обязательным определением активности дефицитного фактора. Ингибиторная форма гемофилии А Наиболее значимым специфическим осложнением терапии препаратами ф.VIII является развитие ингибиторной формы гемофилии. Примерно у 5-20% пациентов с тяжелой формой гемофилии А, получавших препараты ф.VIII, в крови появляются антитела к нему. При высоком титре антител весь вводимый препарат немедленно связывается и выводится из кровотока. Это создает значительные трудности при оказании гемостатической помощи. С практической точки зрения необходимо знать активность развившегося ингибитора. Активность измеряется методом Бетезда (см. ниже) в Бетезда единицах (БЕ). При титре ингибитора до 5 БЕ возможно лечение высокими дозами концентрата ф.VIII. При титре более 5 БЕ необходимы другие пути решения проблемы. В настоящее время для оказания гемостатической помощи пациентам с ингибиторной формой гемофилии применяются препараты, позволяющие запустить коагуляционный каскад «ниже» факторов VIII и IX. Наиболее часто применяются препараты FEIBA и NovoSeven. FEIBA - активированный концентрат факторов протромбинового комплекса. В его состав входят факторы IX, X, VIIa. Его внутривенное введение активирует образование протромбиназ-ного комплекса. NovoSeven - концентрат рекомбинантного активированного фактора VII. В основе механизма гемостатического действия этого препарата лежит значительная активация первого этапа внешнего каскада, происходящая при контакте ТФ и ф.VIIа. Кроме того, этот препарат в терапевтических концентрациях способен активировать ф.IХ и ф.Х на мембране активированных тромбоцитов без участия ТФ.
Поиск по сайту: |