|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Рецепторы для высокомолекулярных белков
Гликопротеиновый комплекс GPIb-V-IX тромбоцитов участвует в опосредованной фактором Виллебранда адгезии тромбоцитов к субэндотели-альным структурам и активации тромбоцитов. Полипептидные цепи GPIba, GPIb(3, GPV, GPIX полностью расшифрованы по аминокислотной последовательности, известны их кодирующие гены. Характерной особенностью комплекса является включение в пептидные цепи 24 аминокислотных остатков с лейцином, которые находятся в строго определенных местах. Эти белки получили название богатых лейцином глико-протеинов (LRG - leucine rich glycoproteins). Связывание фактора Виллебранда с GPIb-V-IX интактных тромбоцитов незначительно. Контакт молекулы фактора Виллебранда с субэн-дотелиальным слоем, особенно при воздействии высокой скорости кровотока, приводит к конфор-мационным изменениям в молекуле, что значительно повышает сродство фактора Виллебранда к GPIb-V-IX. Нефизиологическими стимуляторами процесса взаимодействия фактора Виллебранда и GPIb-V-IX являются антибиотик ристомицин и протеин змеиного яда - ботроцетин. Ристомицин свя- зывается с богатым пролином участком молекулы фактора Виллебранда и с одним или более доменами GPIb на тромбоцитах, а ботроцетин -только с фактором Виллебранда. Эти воздействия приводят к аналогичным физиологическим кон-формационным изменениям молекулы фактора Виллебранда и GPIb-V-IX и резко увеличивают сродство между фактором Виллебранда и тромбоцитарной мембраной. Тромбоцитарный GPIb-V-IX также является высокоаффинным местом связывания тромбина. Взаимодействие GPIb-V-IX с фактором Виллебранда и тромбином приводит к активации тромбоцитов. При врожденной недостаточности рецептор-ного комплекса не происходит связывания с фактором Виллебранда (vWF), что характерно для болезни Бернара-Сулье. Интегрины Кроме богатых лейцином гликопротеинов, на мембране тромбоцитов находится большое количество адгезивных рецепторов, относящихся к семейству иншегринов. Интегрины - трансмембранные гликопротеины, характеризующиеся общно-
Тромбоциты стью протеиновых цепей, антигенных свойств и функции. Они принимают участие во взаимодействии клетки с клеткой и клетки с субэндотелиаль-ным матриксом. Благодаря способности образовывать связи со многими белками интегрины участвуют в процессах распознавания, адгезии, миграции клеток на матриксе, репаративных, иммунных и других реакциях. К семейству интегринов относятся рецепторы к фибриногену, витронекти-ну, фибронектину, коллагену и другим белкам. Интегрины способны распознавать характерную аминокислотную последовательность RGD (трипеп-тид Arg-Gly-Asp), имеющуюся в лигандах. Эта последовательность присутствует во всех адгезивных белках крови, белках α-гранул тромбоцитов, фибриногене, факторе Виллебранда, фибронектине, витронектине, ламинине. Для соединения интегринов с лигандами типична зависимость от двухвалентных катионов Са2+ и Mg2+. Комплекс GPIIb-IIIa является интегриновым рецептором тромбоцитов, который взаимодействует в первую очередь с фибриногеном (фиб-риногеновый рецептор). Это взаимодействие обеспечивает основной путь агрегации тромбоцитов друг с другом через «фибриновые мостики». При врожденном дефиците этого рецептора -тромбостении Гланцмана- резко нарушена или отсутствует агрегация тромбоцитов с большинством индукторов агрегации, в том числе коллагеном, тромбином, АДФ. Агрегация тромбоцитов с этими индукторами также отсутствует в плазме пациентов с афибриногенемией,если фибриноген отсутствует также и в пулах хранения самих тромбоцитов. Наличие в комплексе GPIIb-IIIa мест распознавания RGD объясняет способность этого ин-тегрина соединяться с фактором Виллебранда, фибронектином, витронектином. Показано, что связь GPIIb-IIIa с фактором Виллебранда важна для эффективной агрегации тромбоцитов в условиях воздействия высоких скоростей кровотока. Ключевой особенностью комплекса GPIIb-IIIa является способность исполнять роль рецептора только на поверхности активированных тромбоцитов. Аффинность этого комплекса на поверхности неактивированных клеток очень низкая, а его антигенная характеристика отличается от таковой на активных тромбоцитах. Активация тромбоцитов приводит к значительному повышению аффинности и изменению антигенной характеристики GPIIb-IIIa. Активированные тромбоциты могут связывать на своей поверхности более 40 000 молекул фибриногена посредством GPIIb-IIIa. Это взаимо-
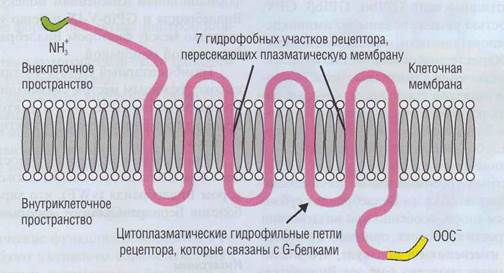
Рис. 20. Тромбиновый рецептортромбоцитарной мембраны, Схожее строение имеют рецепторы к АДФ, адреналину, серотонину, эйкозаноидам и другим низкомолекулярным соединениям. За счет нескольких петель рецептор имеет многофункциональный характер. Внутриклеточный С-конец взаимодействует с цАМФ-зависимой протеинкиназой, гидрофильные петли рецептора активируют опосредуемые G-белками внутриклеточные функциональные перестройки. Со стороны N-конца тромбин вызывает частичный протеолиз и тем самым активирует рецептор
Тромбоциты действие происходит в присутствии двухвалентных катионов (Са2+) и поначалу является обратимым. Далее, по мере образования дополнительных кон-тактов, происходит стабилизация агрегата. У 25% жителей Северной Европы в связи с полиморфизмом аллелей в GPIIIa имеется ассоциация В развитием ишемической болезни сердца и инфаркта миокарда в относительно молодом возрасте. Использование ингибиторов для комплекса GPIIb-IIIa на ранних стадиях тромбоза приводит к быстрому восстановлению кровотока по тром-бированному сосуду и позволяет избежать инфаркта тромбированного органа. Рецепторы для физиологических стимуляторов Рецепторы для физиологических стимуляторов (тромбина, АДФ, адреналина, серотонина, эйкозаноидов и др.) представляют собой трансмембранные пептиды с 7 гидрофобными повторами, которые 7 раз пересекают плазматическую мембрану (рис. 20). Между ними расположены крупные гидрофильные участки, обращенные наружу и внутрь клетки. Цитоплазматический С-конец может фосфорилироваться протеинки-назами, прежде всего цАМФ-зависимой кина-зой. В цитоплазматических петлях находятся места связывания с системой G-белков, которые в качестве внутриклеточных посредников обеспечивают разнообразные физиологические реакции, в первую очередь освобождение внутреннего пула Са2+. Каждый активированный тром-биновый рецептор приводит к образованию нескольких внутриклеточных мессенджеров активации тромбоцитов.
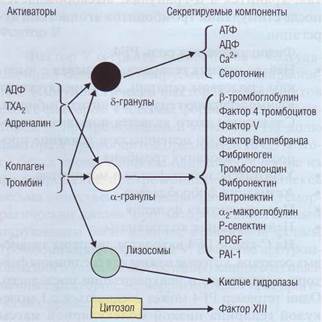
Органеллы тромбоцитов В цитоплазме тромбоцитов расположены митохондрии, пероксисомы (содержат катала-зу), включения гликогена, лизосомы и гранулы, содержащие пулы хранения различных веществ. В тромбоцитах выделяют 3 вида органелл хранения: а-гранулы, электронно-плотные тельца (8-гранулы) и лизосомы (у-гранулы). На рис. 21 представлены основные компоненты, которые могут освобождаться из гранул и цитозола тромбоцитов при действии разных стимуляторов. В а-гранулах хранится до 30 различных белков, большинство из которых были синтезированы еще в мегакариоцитах: β-тромбоглобулин, фактор 4 тромбоцитов, фактор V, фактор Виллеб-ранда, фибриноген, тромбоспондин, фибронек-тин, витронектин, оц-макроглобулин, Р-селектин, фактор роста тромбоцитов (PDGF), ингибитор тканевого активатора плазминогена типа 1 (PAI-1), α2-антиплазмин, α1-антитрипсин, протеин S, лейкоцитарный хемотаксический фактор, высокомолекулярный кининоген и др. Участие белков α-гранул в физиологических и патологических процессах многостороннее: а) митогенный и хемотаксический эффекты; б) адгезивное действие, модулирование агрегации тромбоцитов; в) участие в пламенном гемостазе; г) вазоактивное действие; д) иммунные и другие эффекты. В плотных тельцах (5-гранулы) хранятся субстанции, вызывающие, прежде всего, сосудистые реакции и агрегацию тромбоцитов: адениловые
Рис. 21. Секретируемые факторы тромбоцитовприсутствуют в тромбоцитах в 3 видах гранул хранения. Разные стимуляторы приводят к освобождению содержимого гранул тромбоцитов Тромбоциты
нуклеотиды (АТФ, АДФ, АМФ, ц-АМФ, ГДФ), серотонин, адреналин, норадреналин, дофамин, гистамин, Са2+ и др. Высвобождающиеся из пула хранения АТФ и АДФ быстро метаболизируют-ся в плазме до АМФ и аденозина; последние обладают прямым коронарорасширяющим действием. АДФ является важнейшим физиологическим метаболитом, обеспечивающим первичный гемостаз, стимулируя агрегацию тромбоцитов. В лизосомах (γ-гранулы) находятся гидролитические ферменты - пероксидаза, глюкозидазы, галактозидаза или β-глицерофосфатаза, кислая фосфатаза, неспецифическая эстераза. Лизосомы секретируют хранящийся в них секрет только при необратимой активации. Тромбоциты способны секретировать содержимое гранул как частично при обратимой ак- тивации и в процессе трофических взаимодействий с органной капиллярной сетью, так и полностью при реакции освобождения, связанной с необратимой активацией. После дегрануляции цитоплазма тромбоцитов «опустошена». В неактивированных тромбоцитах цитоплазма может выглядеть «опустошенной» при врожденном дефекте заполнения гранул, приводящем к дефициту пула хранения - синдрому «серых» тромбоцитов. После секреции большинство гранулярных мембран деградирует, гранулы не восстанавливаются, и тромбоциты теряют свою физиологическую активность. Если они находятся в токе крови, измененная форма способствует их быстрой элиминации в селезенке.
Поиск по сайту: |