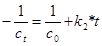|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
РОЗДІЛ 3. Хімічна кінетика
Кінетика - це розділ хімії, який вивчає швидкість хімічних реакцій і їх залежність від різних факторів - природи і концентрації реагуючих речовин, температури, тиску, наявності каталізатора. Вивчення кінетики і механізму хімічних реакцій має велике як теоретичне, так і практичне значення як в хімії, так і в біології і медицині. Відомо, що хімічні реакції протікають з різною швидкістю. Деякі відбуваються миттєво, інші - протягом хвилин, годин і навіть років. Вивчаючи кінетику, можна визначити швидкість проходження лікарських речовин в організмі. За максимальною швидкістю біохімічних реакцій можна визначити активність ферментів. Швидкість хімічних реакцій - це характеристика реакцій, яка відображає зміну концентрації реагуючих речовин (C) за одиницю часу (τ) в одиниці об’єму:
На швидкість гомогенних (однорідних) хімічних реакцій впливають: 1) природа реагуючих речовин; 2) концентрація реагентів; 3) температура; 4) тиск; 5) природа розчинника; 6) наявність каталізатора. Для гетерогенних реакцій, крім названих факторів важливу роль грає поверхня поділу фаз. Природа реагуючих речовин вважається найважливішим фактором, що впливає на швидкість перебігу реакцій. Вирішальну роль відіграє сила і тип хімічного зв’язку. Для органічних речовин, основними типами зв’язку є σ і p-зв’язки. Реакції із речовинами, що мають σ-зв’язки проходять повільніше, ніж реакції речовин із p-зв’язками. Неорганічні сполуки, що мають йонні і полярні ковалентні зв’язки, реагують швидше. Гомогенні реакції (крім твердофазних) протікають швидше, ніж гетерогенні. Швидкість протікання гетерогенної реакції лімітується площею поверхні розділу фаз. Вплив концентрації на швидкість протікання реакції можна визначити використовуючи закон діючих мас, який встановлений норвежськими вченими Гульбергом і Вааге (1864-1867) При постійній температурі швидкість хімічної реакції прямопропорційна діючим масам - молярним концентраціям реагуючих речовин, взятих в ступенях відповідного стехіометричного коефіцієнту . В загальному випадку:
Згідно закону діючих мас швидкість такої прямої реакції можна записати так: uпр.=k1[A]a*[B]b Для зворотньої реакції: uзв.=k2[C]c*[D]d k1 і k2 - це константи швидкості відповідно прямої і зворотної реакції. Фізичний зміст кожної з цих констант такий, що вони відображають природу реагуючих речовин, а числове значення їх відповідає швидкості реакції, коли концентрація кожної із вихідних речовин рівна 1 моль/л. uпр.=k1 uзв.=k2 На практиці швидкість реакції залежить від механізму реакції, який може бути різний в залежності від молекулярності реакції. Молекулярність реакції визначається числом молекул, одночасна взаємодія яких приводить до хімічного перетворення. Одномолекулярною (мономолекулярною) реакцією вважають реакцію в елементарному акті хімічного перетворення якої приймає участь тільки одна молекула. Прикладом таких реакцій є реакції розпаду: Ca(HCO3)2 ® CaCO3 + H2O + CO2 Бімолекулярними реакціями є ті, в елементарному акті хімічної взаємодії яких приймають участь дві молекули. Прикладом таких реакцій є реакція сполучення: J2 + H2 ® 2HJ Відповідно одночасна взаємодія трьох молекул буде тримолекулярною реакцією. А реакції з молекулярністю вище трьох - невідомі. То як же бути з реакціями, в яких приймають участь більше речовин ? На практиці механізм реакції визначається порядком реакції. Порядок реакції визначається як число, що рівне сумі показників що відповідають стехіометричним коефіцієнтам в рівнянні швидкості. Для реакції в загальному вигляді: aA + bB = cC + dD де uпр.=k1[A]a*[B]b і uзв.=k2[C]c*[D]d n1 = a + b і n2 = c + d Однак це дійсне лише для одностадійної реакції. Якщо реакція проходить в кілька стадій, то сумарний підсумок всіх перетворень нижче, ніж теоретична молекулярність реакцій. Є цілий ряд реакцій, в яких приймає участь два компоненти, але швидкість реакцій залежить тільки від одного з них - того, якого є менше, а не іншого, якого є більше. Так реакція гідролізу складного ефіру залежить тільки від концентрації ефіру, але не залежить від концентрації води: CH3-COO-CH3 + H2O = CH3COOH + CH3OH Ця реакція, яка є двомолекулярною, на практиці має перший порядок. u=k1[CH3COOCH3] u=k * c1 Можливий навіть нульовий порядок реакції, який описується рівнянням u=k * co , тобто коли швидкість реакції не залежить від концентрації реагента. Порядок реакції визначають кількома методами: 1) по графіку залежності концентрації реагенту від часу; 2) методом підстановки, порівнюючи дані, одержані підстановкою в рівняння певного порядку, порядок приймається такий, для якого будуть відповідати експериментам дані; 3) методом періоду напівперетворень, згідно якого гранична залежність напівперетворень(t1/2) від концентрації (со ) та її оберненої величини (1/со) повинна мати пряму лінію. Графічний метод полягає в побудові графіків залежності згідно відповідних кінетичних рівнянь. Для реакцій нульового порядку: u=k*сo=ko ko=(co-c1)/t графічно tga=ko (рис. 3.1а) Для реакцій першого порядку: u=k1*c1 Для реакцій другого порядку: u=k2*c2
а б в Рис. 3.1 Графічне визначення порядку і константи швидкості реакцій: а – нульового порядку; б – першого порядку; в – другого порядку.
Для реакцій нульового порядку період напівперетворень: t1/2=co/2ko. Це ферментативні процеси, в яких субстрат перебуває в надлишку. Для реакцій першого порядку період напівперетворення не залежить від початкової концентрації реагуючих речовин. Не залежно від значення початкової концентрації половина кількості речовини прореагує за один і той же час. t1/2= До реакцій першого порядку належить кінцеві стадії ферментативних процесів, реакції антигенів з антитілами, ізомерного перетворення, гідролізу та інші. Період напівперетворення для реакцій другого порядку обернено пропорційно початковій концентрації реагуючих речовин. Чим вища початкова концентрація, тим за більш короткий час буде витрачена її половина. Період напівперетворення дорівнює t1/2= У біохімічних процесах реакції вищого ніж другого порядку не зустрічаються. 4) Інтегральний метод: Будують графік залежності lgu від lgc Одержуємo лінійну залежність: u=k*c lgu=n *lgc + lgk tga=lgk n*lgc= tga - lgu n=( tga - lgu)/lgc
lgc Рис. 3.2 Графік залежності lgu від lgc
Залежність швидкості реакції від різних факторів. Підвищення температури значно збільшує швидкість реакції. Це можна пояснити збільшенням хаотичності руху молекул, що приводить до збільшення кількості зіткнень. Залежність швидкості реакції від температури визначається емпіричним правилом Вант-Гоффа, при підвищенні температури реакції на 10 0С швидкость реакції зростає в 2-4 рази. Це залежить від природи реагуючих речовин і визначається температурним коефіцієнтом g, який можна розрахувати g = Kt+10 / Kt,, В організмі людини і тварин більшість реакцій протікають за участю білкових каталізаторів - ферментів. З підвищенням температури швидкість біохімічних реакцій значно зростає, температурний коефіцієнт зростає (7-10) і береться для більш вузького діапазону температур (2,3,50). Температурний коефіцієнт в різних діапазонах не постійний. Не треба забувати вузький температурний діапазон ферментативних реакцій - оптимальним діапазоном яких є 36–42 0С. При температурі вище 42 0С проходить до термоденатурації білка і швидкість хімічних реакцій сповільнюється. Вплив тиску на швидкість хімічних реакцій має велике значення для реакцій в газовій фазі і дуже мале для твердофазних і рідкофазних реакцій. На реакції в газовій фазі тиск впливає так само, як і зміна концентрації. Пряма залежність між р і с дозволяє використати рівняння швидкості в такому вигляді: uпр= K1 * рАа * рВв Вплив розчинника на швидкість реакції має значення для рідкофазних реакцій. Розчинник може прискорювати реакцію, впливаючи на поляризацію зв’язків в речовині. А полярні розчинники можуть збільшувати швидкість переходу реагуючих молекул в активну йонізовану форму.
Поиск по сайту: |
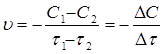

 aA + bB cC +dD
aA + bB cC +dD
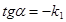 (рис. 3.1б)
(рис. 3.1б)
 (рис. 3.1в)
(рис. 3.1в)





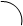 a a a
a a a


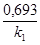
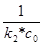
 lgu
lgu
 a
a