 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Порядок выполнения работы. 1. Вывести на минимум ручки потенциометров и тумблеры в исходное положение
1. Вывести на минимум ручки потенциометров и тумблеры в исходное положение 2. Подать на установку питание, включив тумблер «ВКЛ» в модуле «СЕТЬ». 3. Включить тумблер «ВКЛ» в модуле «НАГРЕВ». 4. Регулятором «НАГРЕВ» модуля установить заданную мощность нагрева. Нагреть образец немного выше температуры плавления ( 5. Снять зависимость температуры как функции времени Т=f(t) в процессе охлаждения и кристаллизации образца. Показания регистрировать через 15 секунд (до 6. Построить график зависимости Т = f(t). Для нахождения точек A и D на оси абсцисс влево и вправо откладывать отрезки Dt, равные времени кристаллизации металла, 7. Оценить приращение энтропии по формуле (2), исходя из экспериментальных результатов, полученных для олова. Сделать выводы. Контрольные вопросы 1. Что называется переходом первого рода? 2. Что понимается под фазой вещества? 3. Чем отличаются кристаллические твёрдые тела от аморфных твёрдых тел? 4. Что происходит при плавлении твёрдых кристаллических тел и аморфных тел? 5. В чём суть метода определения удельной теплоты плавления металлов? 6. Запишите математическое выражение второго начала термодинамики. 7. В чём заключается физический смысл понятия энтропии? 8. Как объяснить приращение энтропии при плавлении металла? Лабораторная работа № 2-6 ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ УДЕЛЬНЫХ ТЕПЛОЕМКОСТЕЙ ВОЗДУХА Цель работы: Ознакомиться с применением первого начала термодинамики к процессам в газах. Задача работы: Определить отношение удельных теплоемкостей воздуха при постоянном давлении и объеме методом Клемана-Дезорма.
Теория Теплоемкостью тела называется физическая величина, численно равная количеству теплоты, которое нужно подвести к телу или отнять от него для изменения его температуры на 1K. Теплоемкость, отнесенная к единице массы вещества, называется удельной теплоемкостью; теплоемкость, отнесенная к одному молю вещества, называется молярной. Обе эти величины являются характеристикой вещества, из которого состоит тело. Из определения теплоемкости следует, что она выражается в Дж/К. Удельная теплоемкость измеряется в Дж/(кг*К), а молярная - в Дж/(моль*К). Между молярной теплоемкостью Согласно первому началу термодинамики, количество теплоты, сообщаемое термодинамической системе, идет на изменение ее внутренней энергии Если нагревание происходит в условиях, когда объем остается постоянным, то соответствующая теплоемкость называется теплоемкостью при постоянном объеме, или изохорической теплоемкостью, и обозначается Так как теплота при этом тратится лишь на изменение внутренней энергии Если же при нагревании остается неизменным давление, то теплоемкость называется теплоемкостью при постояном давлении, или изобарической теплоемкостью, и обозначается Первое начало термодинамики принимает вид: Из уравнения состояния идеального газа Величина отношения теплоемкостей газов Существует несколько способов измерения
Поиск по сайту: |
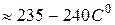 ). Отключить нагрев.
). Отключить нагрев. ).
). (участок ВС на кривой).
(участок ВС на кривой). и удельной
и удельной 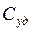 существует очевидное соотношение
существует очевидное соотношение  . где
. где  - молярная масса вещества. Если моль вещества нагревается не на 1К, а на
- молярная масса вещества. Если моль вещества нагревается не на 1К, а на  , то количество затраченной теплоты равно
, то количество затраченной теплоты равно  . Откуда
. Откуда  (1)
(1) и на совершение работы
и на совершение работы  :
: 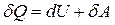 .
. :
:  .
. и
и  .
. :
:  , откуда
, откуда 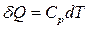 .
. , откуда
, откуда  .
. следует, что
следует, что  , т.е.
, т.е. (уравнение Роберта Майера). Оно показывает, что
(уравнение Роберта Майера). Оно показывает, что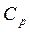 больше
больше  на величину универсальной газовой постоянной
на величину универсальной газовой постоянной  .
. обозначается
обозначается  . Она зависит от сорта газа, т.е. числа степеней свободы ( i ) молекул газа. В классической теории теплоемкостей
. Она зависит от сорта газа, т.е. числа степеней свободы ( i ) молекул газа. В классической теории теплоемкостей  . Соответственно для одноатомных газов (
. Соответственно для одноатомных газов (  ),
),  , для двухатомных (
, для двухатомных (  ),
),  , и для трех- и многоатомных газов с нелинейными жесткими молекулами (
, и для трех- и многоатомных газов с нелинейными жесткими молекулами (  ),
),  . Величина
. Величина  играет важную роль в теории теплоемкостей газов. Она входит в уравнение Пуассона (
играет важную роль в теории теплоемкостей газов. Она входит в уравнение Пуассона (  ). Зная
). Зная  ,можно не прибегая к непосредственному измерению
,можно не прибегая к непосредственному измерению 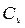 , которое порой затруднено, оценить эту величину.
, которое порой затруднено, оценить эту величину.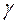 . В данной работе представлен способ оценки величины
. В данной работе представлен способ оценки величины