 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Молекулярно - атомное строение вещества
Изучение взаимодействия между атомами и молекулами показало, что на сравнительно больших расстояниях между ними действуют силы притяжения, а на малых расстояниях - силы отталкивания. По своей природе они являются силами электромагнитного происхождения. Агрегатное состояние вещества определяется соотношением между средней кинетической энергией движения молекул и средней потенциальной энергией взаимодействия молекул.Из трех агрегатных состояний, в которых может находиться вещество, наиболее простым является газообразное, так как в этом случае силы, действующие между молекулами, очень малы и ими при определенных условиях можно пренебречь. У газов средняя кинетическая энергия много больше модуля средней потенциальной энергии взаимодействия (помните, что потенциальная энергия взаимодействия при притяжении отрицательна), то есть полностью подавлена тенденция молекул к сцеплению. Этим объясняется то, что объем и форма вещества в газообразном состоянии определяются сосудом, в который оно помещено. При отсутствии сосуда вещество стремится заполнить все пространство. В твердом состоянии молекулы и атомы сильно сцеплены друг с другом. Поэтому вещество в твердом состоянии сохраняет как форму, так и объем. При деформации возникают силы, стремящиеся восстановить и форму и объем. Молекулы или атомы твердого тела располагаются в определенных местах и образуют кристаллическую решетку. Они колеблются около средних положений, называемых узлами кристаллической решетки; покидать небольшую область вблизи узлов они, как правило, не могут. Линия, вдоль которой происходят колебания, и амплитуда колебаний меняются с течением времени, но за большие по сравнению с периодом колебаний промежутки времени. Вдоль фиксированной линии совершается достаточно много колебаний, прежде чем направление линии колебаний изменится. Жидкое состояние характеризуется тем, что вещество стремится сохранить объем, но не сохраняет формы. Отметим, что шарообразная форма жидкостей в условиях невесомости не противоречит этому утверждению. Жидкость всегда принимает ту форму, которая соответствует действующим на нее силам. В условиях невесомости на нее действуют силы поверхностного натяжения, и шарообразная форма соответствует общему условию устойчивости. Молекулы в жидкости находятся близко друг к другу, как бы соприкасаясь. Однако их относительные положения не фиксированы и они сравнительно медленно меняют положения друг относительно друга. Иногда молекулы соединяются в агрегаты, состоящие из большого числа молекул, причем агрегатное расположение их определенным образом упорядочено. В этом случае жидкости обладают свойствами, характерными для твердых кристаллических тел (жидкие кристаллы). В настоящее время достаточно хорошо разработаны теории газообразного и твердого состояний. Теория жидкого состояния наименее разработана. Таким образом, газообразное состояние является наиболее простым. Поэтому мы начнем с рассмотрения свойств газов. При этом будем считать, что межмолекулярные силы в них полностью отсутствуют. Молекулы будем считать материальными точками. При таких допущениях молекулы газа можно считать совершенно свободными, сталкивающимися между собой по законам соударения шаров. Газ, обладающий такими свойствами, называется идеальным газом. В молекулярной физике массы атомов и молекул измеряют в относительных единицах. Их называют относительная атомная и молекулярная масса. За единицу атомной массы
Относительная атомная масса определяется:
Аналогично определяется относительная молекулярная масса:
Количество вещества определяется количеством структурных элементов. За единицу количества вещества принимается моль. Моль это физическая величина, содержащая столько структурных элементов, сколько содержится в 0,012 кг изотопа углерода Моль любого вещества содержит одно и то же количество структурных элементов (атомов и молекул). Это число называется числом Авогадро.
В молекулярной физике используют понятие молярной массы. Это масса 1 моля вещества
Число молей это количество молей содержащихся в единице массы
Молекула – это наименьшая частица вещества, сохраняющая все его химические свойства.
Поиск по сайту: |
 принимают 1/12 часть массы изотопа углерода
принимают 1/12 часть массы изотопа углерода  .
. кг.
кг. .
. .
. .
.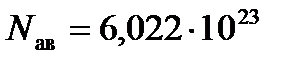 (1/моль).
(1/моль). .
. или
или  .
.